| Este artigo é patrocinado por: «A sua instituição aqui» |
A fosfolipase C (PLC) é uma enzima localizada na membrana plasmática que converte um fosfolípido membranar em duas moléculas que desempenham o papel de mensageiros secundários no interior da célula. O fosfolípido hidrolisado pela fosfolipase C é o fosfotidil inositol-4,5-bisfosfato (PIP2) e os produtos da reação são o Inositol trifosfato (IP3) e o Diacilglicerol (DAG).
A figura seguinte mostra o esquema da reação:
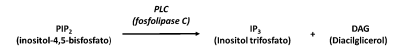
Figura 1 – Esquema da reação promovida pela fosfolipase C.
Os produtos desta reação, o IP3 e o DAG, vão ativar outros componentes celulares. O IP3 vai induzir a libertação de iões de cálcio (Ca2+) a partir do retículo endoplasmático. Já o DAG vai ativar a proteína cinase (PKC), uma enzima que promove a fosforilação de determinados substratos celulares.
Classificação
Até ao momento foram identificadas no total 13 isozimas da fosfolipase C nos mamíferos. Estas 13 isozimas foram classificadas em seis subtipos (ver Figura 2):
- Fosfolipase C beta (PLC-β) 1 a 4;
- Fosfolipase C gama (PLC-γ) 1 e 2;
- Fosfolipase C delta (PLC-δ) 1, 3 e 4;
- Fosfolipase C épsilon (PLC-ε);
- Fosfolipase C zeta (PLC-ζ);
- Fosfolipase C eta (PLC-η) 1 e 4;
A PLC-β e a PLC-γ são ditas fosfolipases C primárias porque são ativadas primariamente por estímulos extracelulares. As restantes fosfolipases C são designadas secundárias porque são ativadas secundariamente por componentes intracelulares como as Rho e Ras GTPases (no caso da PLC-ε) e pelos iões de cálcio (no caso da PLC-δ1 e PLC-η1).
A PLC-β é ativada através dos recetores acoplados à proteína G. A PLC-γ é ativada através dos recetores tirosina-cinase. Já a PLC-ε pode ser ativada pelos 2 tipos de recetores mencionados anteriormente mas através de mecanismos diferentes.
A PLC-δ e a PLC-η são ativadas pelo cálcio mobilizado pela transdução do sinal via recetores acoplados à proteína G.
A ativação da PLC-ζ ainda não está totalmente esclarecida.
O ácido fosfatídico que se forma a partir da fosforilação da DAG (pelas DAG cinases) ou da hidrólise da fosfatidilcolina (pela fosfolipase D) estimula a atividade lipásica das PLC-β, PLC-δ, PLC-γ e PLC-ε.
A tabela seguinte sintetiza as características de cada isozima de fosfolipase C.
| Subtipo | Nº isoformas | Classificação | Ativada por |
| PLC-β | 4 | Primária | Recetores acoplados à proteína G |
| PLC-γ | 2 | Primária | Recetores tirosina-cinase |
| PLC-δ | 3 | Secundária | Ácido fosfatídico e cálcio |
| PLC-ε | 1 | Secundária | Recetores acoplados à proteína G, recetores tirosina-cinase, ácido fosfatídico, Rho e Ras GTPases |
| PLC-ζ | 1 | Secundária | Desconhecido |
| PLC-η | 2 | Secundária | Cálcio |
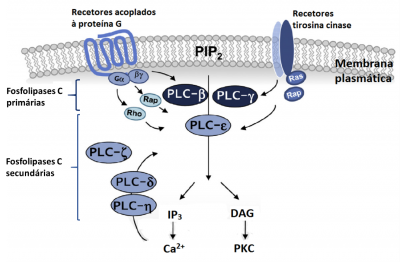
Figura 2 – Esquema que representa as diferentes fosfolipases C, primárias e secundárias, e os seus mecanismos de ativação e atuação. Adaptado de Yang, Y.R. et al. (2013).
Estrutura
As fosfolipases C são proteínas solúveis com massas moleculares compreendidas entre 85 e 150 kDa. Todas as fosfolipases têm uma estrutura básica em comum (ver Figura 3) que é caracterizada pela presença de:
- Um domínio designado homologia de pleckstrin (PH) na extremidade N-terminal. Este domínio está ausente na PLC-ζ.
- Quatro motivos consecutivos de mãos EF a seguir ao domínio PH.
- O centro catalítico composto por um barril de triose fosfato isomerase (TIM). O barril TIM é composto por um domínio X e Y que estão ligados por um linker X-Y auto-inibitório.
- O domínio C2 na extremidade C-terminal.
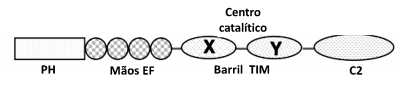
Figura 3 – Representação linear dos diferentes domínios da PLC-δ1. Adaptado de Rebecchi & Pentyala (2000).
References:
- Litosch, I. (2015). Regulating G protein activity by lipase-independent functions of phospholipase C. Life Sciences, 137: 116-124.
- Rebecchi, M. J., Pentyala, S.N. (2000). Structure, Function, and Control of Phosphoinositide-Specific Phospholipase C. Physiological Reviews, 80 (4): 1291-1335.
- Singh, A. et al. (2015). Plant phospholipase C family: Regulation and functional role in lipid signaling. Cell Calcium, 58: 139-146.
- Yang, Y.R. et al. (2013). The physiological roles of primary phospholipase C. Advances in Biological Regulation, 53: 232–241.





