Gás- conceito

gás
Gás é a designação dada a um dos estados físicos da matéria, sendo que este não possui forma, nem volume, estando estes dependentes do recipiente que os contêm. Os outros estados da matéria são o solido e o líquido e cada um possui características diferentes.
O estado da matéria depende das características que um determinado elemento químico tem. Uma substancia é considerada um gás quando esta se encontra nas condições atmosféricas normais, a uma temperatura de 25ºC e com uma pressão atmosférica de 1 atm (atmosfera).
As variações de temperatura e pressão permitem prever o comportamentos dos gases pois quanto maior a temperatura maior o movimento dos átomos ou moléculas que compõem o gás e quanto maior for a pressão exercida sobre o gás, menor serão os movimentos desses átomos ou moléculas.
Apesar de existirem gases compostos por moléculas, as substâncias moleculares encontram-se maioritariamente no estado solido, sendo necessário exercer um aumento de temperatura para que estas mudem de estado.
A constituição de um gás depende dos elementos químicos que o constituem, podendo este ser uma gás puro (constituído por um único elemento) ou pode ser composto (formado por diferentes elementos), existindo por isso diferentes tipos de gás.
A maior parte dos elementos químicos representados na tabela periódica e que correspondem a não-metais encontram-se no estado gasoso, isto é, são todos gases, quando se encontram à temperatura ambiente.
O gás é diferente de vapor de água, apesar de o último poder ser considerado um gás, a principal diferença entre os dois termos é o facto de o gás se no estado gasoso encontrar em condições normais de temperatura e pressão, enquanto o vapor de água em condições de pressão e temperaturas ambiente encontra-se em estado liquido.
Propriedades:
Os gases apresentam um movimento molecular caótico, pois cada molécula ou átomo que forma o gás move-se livremente em todas as direções independentemente umas das outras.
A movimentação das moléculas cria a pressão do gás, pois estas moléculas colidem umas com as outras. A pressão do gás varia com o aumento da pressão ou o aumento do volume.
A densidade dos gases é muito baixa, particularmente quando comparado com as densidades dos líquidos e dos sólidos, visto os gases não provocarem grande resistência pois as suas moléculas estão separadas por distancias muito grandes.
Esta relação permite criar uma equação tendo em conta os princípios da mecânica Newtoniana, a pressão é igual a um terço da multiplicação entre a massa do gás e a sua velocidade ao quadrado, a dividir pelo volume do gás.
O contacto com gases pode ou não ser inofensivo, tanto para o ser humano, assim como para qualquer ser vivo, alguns gases são bastante tóxicos, enquanto outros são muito inofensivos.
Gás perfeitos:
Um gás é considerado perfeito quando se rege pelos princípios da mecânica Newtoniana. As moléculas não se atraem nem se repulsão, estando em perfeito equilíbrio.
Estes gases são hipotéticos pois assume-se que existe uma relação entre a pressão, o volume e a temperatura tão perfeita que pode ser descrita pela equação dos gases perfeitos:
P (pressão)* V(volume)= n(número de moles)* R (constante de Avogadro)* T (temperatura)
Apesar de não existirem gases perfeitos na natureza é possível utilizar esta fórmula pois os valores encontrados na natureza não possuem características que afetem significativamente os cálculos, sendo possível usa-la na resolução de muitos problemas com gases. Esta lei permite assim descrever as relações de quantidade e volume entre os gases.
Gases nobres:
Os gases nobres são os gases que se encontram no grupo 18 da tabela periódica. Estes gases são o Hélio (He), o Néon (Ne), o Argon (Ar), o Cripton (Kr), o Xenônio (Xe), o Rádon (Rn) e o Oganesson (Og).
Durante muito tempo acreditou-se que estes elementos não eram reativos, não podendo por isso formar ligações com outros elementos da tabela periódica.
Inicialmente pensava-se tratarem-se de gases raros, dai a designação do seu grupo, no entanto, alguns destes gases encontram-se facilmente no planeta, mas a sua abundância vai diminuindo com o seu número atómico.
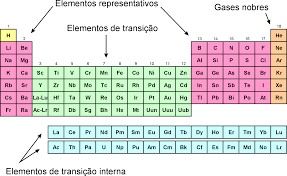
Tabela Periódica
O estudo dos gases foi e continua a ser de grande interesse para a química e para a física, existindo por isso muito mais que se poderia dizer sobre um gás. Estes são governados por um grande número de leis e teorias (como a teoria cinética dos gases) que intervêm no nosso dia-a-dia, como por exemplo a viscosidade do sangue ou mesmo turbulência dos aviões, havendo muito ainda por se descobrir.
References:
Chang, Raymond (1994). Quimica. 5ª edição. McGraw-Hill. Lisboa, Portugal. ISBN: 972-9241-68-6
Schrobilgen, Gary J.(2017). Noble Gas. Encyclopædia Britannica, inc. Consultado em: Setembro 30, 2017, em https://www.britannica.com/science/noble-gas





