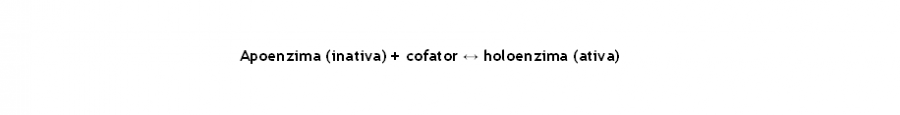
As enzimas catalisam uma grande variedade de reações químicas. Os seus grupos funcionais podem “facilmente” participar nas reações ácido-base, formar diversos tipos de ligações covalentes transitórias e também interagirem e integrarem nas interações iónicas. Contudo, as enzimas são menos adequadas para catalisar reações de oxidação-redução. Ainda que as enzimas catalisam essas reações, estas fazem-no principalmente em associação com pequenas moléculas denominadas de “cofatores”, que essencialmente atuam como as enzimas. Assim sendo, os cofatores podem ser iões metálicos, tais como o zinco (Zn+), imprescindíveis para a atividade catalítica da carboxipeptidase A, ou moléculas orgânicas, tais como o NAD+ (Dinucleótido de nicotinamida) e o YADH (Álcool desidrogenase de levedura). No entanto, alguns cofatores, como por exemplo o NAD+, está transientemente associado com uma dada molécula de enzima, de modo que, funcione como um co-substrato. Todavia, outros cofatores como os grupos prostéticos estão essencialmente associados a uma proteína, através de ligações covalentes. Por exemplo, o grupo prostético heme da hemoglobina está estreitamente relacionada com a sua proteína de ligação a partir de interações hidrofóbicas e de pontes de hidrogénio, conjuntamente com uma ligação covalente entre o ião ferro (Fe2+) e a Histidina (His) F8. Ainda assim, as coenzimas são quimicamente alteradas através das reações enzimáticas em que participam. Assim, a fim de completar o ciclo catalítico, a coenzima deve ser devolvida ao seu estado original. Contudo, para os grupos prostéticos, isto pode ocorrer apenas numa fase separada da sequência da reação enzimática. Porém, para as coenzimas transitoriamente ligadas, tais como NAD+, a reação de regeneração pode ser catalisada por uma enzima diferente. Um complexo enzima – cofator cataliticamente ativo é designado de holoenzima (em grego: holos, todos). Por outro lado, a proteína enzimaticamente inativa, resultante da remoção de um cofator de holoenzima, é referida como uma apoenzima (em grego: apo, distância); isto é:
- Muitas vitaminas são coenzimas percursoras: Muitos organismos são incapazes de sintetizar certas partes de cofatores essenciais, assim sendo, estas substâncias devem estar presentes/integrarem a dieta do organismo. É o caso das vitaminas. Na verdade, muitas coenzimas foram descobertas como fatores de crescimento para os microrganismos ou substâncias que tratam/curam doenças relacionadas com a deficiência nutricional. Por exemplo, o NAD+ que é um componente da nicotinamida (alternativamente conhecido como niacinamida) ou o ácido carboxílico sendo o seu análogo o ácido nicotínico, alivia a deficiência alimentar humana conhecida como “Pelagra”. Assim, a Pelagra é uma doença caracterizada por diversos sintomas, tais como, a diarreia, dermatite e demência, tendo sido endémica nas zonas rurais do sul dos Estados Unidos da América no início do século XX. Mas, a maioria dos animais, incluindo os seres humanos, podem sintetizar nicotinamida a partir do aminoácido triptofano (Trp). A dieta rica em milho que era característica destas zonas rurais continha pouca nicotinamida e triptofano disponíveis para a absorção humana. Na verdade, o milho contém quantidades significativas de nicotinamida, mas de uma forma que requer tratamento com uma base antes de poder ser absorvido no intestino. Por outro lado, as vitaminas presentes na dieta humana, que são precursores de coenzimas são todas vitaminas solúveis em água. Em contraste, as vitaminas solúveis em lípidos, tais como, a vitamina A e a vitamina D, não são componentes de coenzimas, embora estas também sejam necessárias em quantidades vestigiais nas dietas de muitos animais superiores. Os ancestrais distantes dos seres humanos, provavelmente tiveram a capacidade de sintetizar as várias vitaminas, tal como ainda observado em diversas plantas e microrganismos. No entanto, uma vez que as vitaminas estão normalmente disponíveis nas dietas de animais superiores, é de esperar que a maquinaria celular utilizada para a sua síntese fosse gradualmente ficando inativada através da evolução.
Outros assuntos relacionados:
- Estabilidade das proteínas;
- Dinâmica da proteína;
- Proteínas globulares;
- Estrutura primária das proteínas;
- Estrutura secundária da proteína;
- Estrutura terciária da proteína;
- Estrutura quaternária da proteína.
References:
- Friedmann, H.C. (Ed.), Enzymes, Hutchinson Ross (1981).
- Fruton, J.S., Molecules and Life, pp. 22–86,Wiley (1972).
- Creighton,D.J. and Murthy,N.S.R.K., Stereochemistry of enzymecatalyzed reactions at carbon, in Sigman, D.S. and Boyer, P.D. (Eds.), The Enzymes (3rd ed.),Vol. 19, 323–421, Academic Press (1990).