O enxofre é o décimo elemento mais abundante no universo, sendo um dos componentes presentes nas proteínas e vitaminas. A maior parte do enxofre presente na terra está armazenado nas rochas e minerais, maioritariamente em forma de gipsita (CaSO4) e pirite (FeS2), e nos oceanos em forma de aniões sulfato (2,6 g/L), em sulfureto de hidrogénio dissolvido e como enxofre elementar. Também é possível encontrar enxofre na água doce (sulfato, sulfato de hidrogénio e enxofre elementar), na terra (em forma de sulfato) e na atmosfera como óxido de enxofre (SO2) e ácido metanossulfónico (CH3SO3–).
O ciclo do enxofre é um ciclo complexo que contempla tanto processos que ocorrem na atmosfera como na terra (Fig 1). Nos processos terrestres, o ciclo começa com a fragmentação das rochas, libertando o enxofre armazenado. O enxofre entra em contacto com o ar, sendo convertido em sulfato (SO4). O sulfato é então absorvido pelas plantas e microorganismos e é transformado posteriormente em formas orgânicas. Como os organismos morrem e se decompõem, alguma parte do enxofre é de novo libertado em forma de sulfato, enquanto outra parte é assimilada por microorganismos. Há também várias fontes naturais que libertam enxofre directamente para a atmosfera, como as erupções vulcânicas, a decomposição de matéria orgânica em pântanos e planícies de maré e a evaporação da água. No entanto, o enxofre é também libertado da atmosfera para a terra através da precipitação. Nos ecossistemas terrestres, há uma perda contínua do enxofre para os lagos e rios, e eventualmente para os oceanos. Nos ecossistemas marinhos, o enxofre move-se ao longo das cadeias tróficas, sendo que parte do enxofre é de novo libertado para a atmosfera e outra parte é combinada com ferro (Fe) para formar sulfeto de ferro (responsável pela cor preta na maior parte dos sedimentos marinhos).
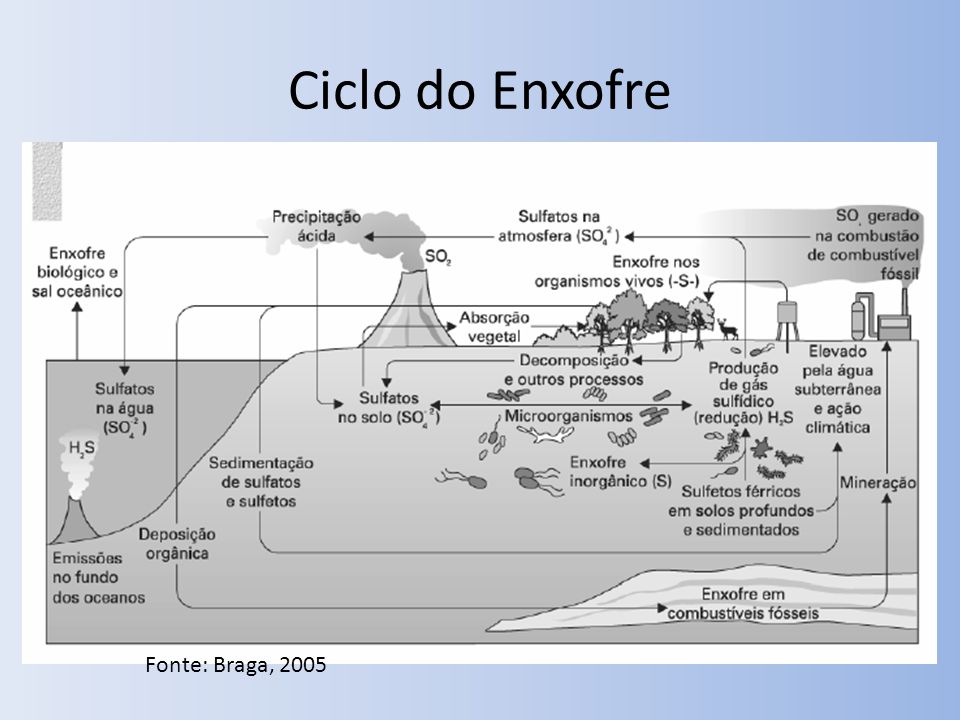
Fig 1. Ciclo do Enxofre
Ao longo do seu ciclo, o enxofre transforma-se em vários compostos químicos diferentes, sendo isto possível devido aos vários estados redox que o enxofre pode ter. Desta forma, o enxofre interage com vários processos biológicos e com outros nutrientes. Por exemplo, o enxofre oxidado pode ser utilizado como aceitador de electrões na respiração de carbono orgânico, num processo semelhante à desnitrificação. Existem outras transformações únicas no ciclo do enxofre, tal como a utilização do sulfureto como doador de electrões na quimiossíntese (por exemplo, por bactérias sulfurosas), produzindo-se sulfureto num processo semelhante à utilização de água como doador de electrões na fotossíntese.
Contudo, desde a Revolução Industrial que as atividades humanas têm contribuído para o aumento da quantidade de enxofre que entra na atmosfera, maioritariamente através da queima de combustíveis fósseis e processamento e transformação de metais. Actualmente, um 1/3 da quantidade de enxofre libertado para a atmosfera é derivado de atividades humanas. Estas emissões, juntamente com as emissões de azoto (ver Ciclo do Azoto), reagem com outros compostos químicos presentes na atmosfera formando-se assim pequenas partículas de sais de sulfato – chuva ácida – causando uma variedade de consequências para o meio ambiente.
References:
- Cunningham, William P. and Barbara Woodworth Saigo, Environmental Science: A Global Concern. McGraw Hill: 1999
- Dodds, W. K. (2002). Freshwater Ecology- Concepts and Environmental Applications. California: Academic Press.





