Conceito de Toxina colérica
A existência de uma toxina responsável pelos sintomas da cólera foi proposta em 1884 por Robert Koch, que suspeitou que o agente responsável pela cólera produzia “um veneno especial” que atuava no epitélio intestinal e que os sintomas da cólera poderiam ser “considerados como um envenenamento”. A existência desta toxina hipotética foi demonstrada em 1959 por dois grupos independentes de investigadores que trabalhavam na Índia. De et al. e Dutta et al. demonstraram que ocorria uma perda de fluidos quando as culturas filtradas ou lisadas de Vibrio cholerae eram introduzidas no trato intestinal de um coelho. A purificação da toxina, 10 anos mais tarde, por Finkelstein e LoSpalluto permitiu que numerosos investigadores descobrissem propriedades fundamentais dessa toxina tais como a sua estrutura, o seu recetor e o seu modo de ação.
Estrutura da toxina colérica
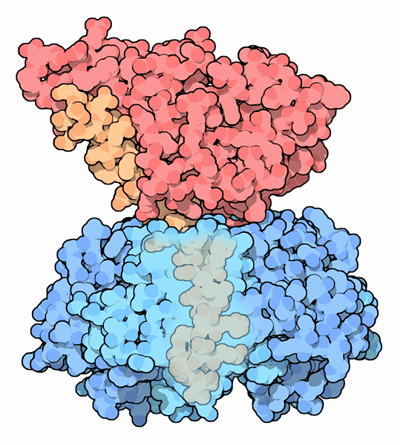
Representação tridimensional da toxina colérica (Goodsell, D., 2005)
A toxina colérica (CT) é uma proteína que pertence à família das toxinas do tipo A-B. A subunidade B serve de transportador para a holotoxina até ao recetor da célula eucariótica e a subunidade A possui uma função enzimática específica que atua intracelularmente. A toxina colérica possui um peso molecular total de mais ou menos 85.2 KDa. A holotoxina A possui um peso molecular de mais ou menos 27.2 KDa e a subunidade B, por sua vez, é composta por cinco cadeias polipeptídicas idênticas de 11.6 KDa e com, cada uma, 103 aminoácidos.
A toxina colérica é codificada por uma unidade de transcrição, que contém o gene CtxA que codifica a subunidade A e o gene CtxB que codifica a subunidade B, presente no genoma do fago CTXΦ (CTXphi). Os genes do fago são transmitidos ao vibrião por transferência horizontal do plasmídeo e são integrados no genoma da bactéria, conferindo-lhe a patogenicidade.
Mecanismo de ação da toxina colérica
O alvo intracelular da toxina colérica é a adenilciclase, um dos sistemas mais importantes de regulação das células eucarióticas. Esta enzima medeia a transformação do ATP em AMP cíclico (cAMP), um mensageiro intracelular crucial numa grande variedade de processos celulares. Normalmente, a adenilciclase é ativada ou inativada em resposta a uma variedade de estímulos. A regulação da adenilciclase é mediada pela proteína G, proteína que funciona como elo de ligação de muitos recetores celulares de superfície à proteína efetora na membrana plasmática. As proteínas G são heterotrímeros compostos por três subunidades distintas: a, b e γ. A proteína G específica envolvida neste caso é a proteína Gs, cuja ativação leva ao aumento da atividade adenilciclase. A toxina colérica catalisa a transferência de ADP-ribose do NAD (Dinucleótido de Nicotinamida e Adenina) para um resíduo específico de arginina na proteína Gsa, resultando na ativação da adenilcilase e consequentemente no aumento do nível intracelular de cAMP. O cAMP ativa uma proteína cinase dependente de cAMP, que leva à fosforilação da proteína, à alteração do transporte iónico e finalmente à diarreia.
References:
- Goodsell, D. (2005). Molecule of the month: Cholera Toxin. Available: http://pdb101.rcsb.org/motm/69. Last accessed 4th Jul 2016.
- Faruque, S.M. and G.B. Nair. 2002. Molecular ecology of toxigenic Vibrio cholera. Microbiol. Immunol., 46(2):59-66
- Lau, O.L., 2004. Vibrio cholera: Epidemiology, ecology, evolution and climate change. Reed College, Portland, OR.
- Peterson, K.M. 2002. Expression of V. cholera virulence genes in response to environmental signals. Curr. Issues. Microbiol. 3:29-38




