La fosfolipasa C (PLC) es una enzima localizada en la membrana plasmática que convierte un fosfolípido membranar en dos moléculas que desempeñan el papel de mensajeros secundarios en el interior de la célula. El fosfolípido hidrolizado por la fosfolipasa C es el fosfatidilinositol 4,5-bifosfato (PIP2) y los productos de la reacción son el Inositol trifosfato (IP3) y el Diacilglicerol (DAG).
A siguiente figura muestra el esquema de la reacción:
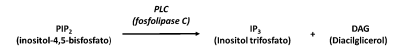
Figura 1 – Esquema de la reacción promovida por la fosfolipasa C.
Los productos de esta reacción, el IP3 y el DAG, van a activar otros componentes celulares. El IP3 va a inducir la liberación de iones de calcio (Ca2+) a partir del retículo endoplasmático. Por su lado el DAG va a activar la proteína cinasa (PKC), una enzima que promueve la fosforilación de determinados sustratos celulares.
Clasificación
Hasta el momento fueron identificadas un total de 13 isozimas de la fosfolipasa C en los mamíferos. Estas 13 isozimas fueron clasificadas en seis subtipos (ver Figura 2):
- Fosfolipasa C beta (PLC-β) 1 a 4;
- Fosfolipasa C gama (PLC-γ) 1 e 2;
- Fosfolipasa C delta (PLC-δ) 1, 3 e 4;
- Fosfolipasa C épsilon (PLC-ε);
- Fosfolipasa C zeta (PLC-ζ);
- Fosfolipasa C eta (PLC-η) 1 e 4;
La PLC-β y la PLC-γ son fosfolipasas C primarias porque son activadas primariamente por estímulos extracelulares. Las restantes fosfolipasas C son designadas secundarias porque son activadas secundariamente por componentes intracelulares como las Rho y Ras GTPasas (en el caso de la PLC-ε) y por los iones de calcio (en el caso de la PLC-δ1 y PLC-η1).
La PLC-β es activada a través de los receptores acoplados a la proteína G. La PLC-γ es activada a través de los receptores tirosina-cinasa. Por su lado, la PLC-ε puede ser activada por los 2 tipos de receptores mencionados anteriormente pero a través de mecanismos diferentes.
La PLC-δ y la PLC-η son activadas por el calcio movilizado por la transducción de la señal a través de receptores acoplados a la proteína G.
La activación de la PLC-ζ aún no está totalmente esclarecida
El ácido fosfatídico que se forma a partir de la fosforilación de la DAG (por las DAG cinasas) o de la hidrólisis de la fosfatidilcolina (por la Fosfolipasa D) estimula la actividad lipásica de las PLC-β, PLC-δ, PLC-γ y PLC-ε.
La siguiente tabla sintetiza las características de cada isozima de fosfolipasa C.
| Subtipo | Nº isoformas | Clasificación | Activada por |
| PLC-β | 4 | Primaria | Receptores acoplados a la proteína G |
| PLC-γ | 2 | Primaria | Receptores tirosina-cinasa |
| PLC-δ | 3 | Secundaria | Ácido fosfatídico y calcio |
| PLC-ε | 1 | Secundaria | Receptores acoplados a la proteína G, receptores tirosina-cinasa, ácido fosfatídico, Rho y Ras GTPasas |
| PLC-ζ | 1 | Secundaria | Desconocido |
| PLC-η | 2 | Secundaria | Calcio |
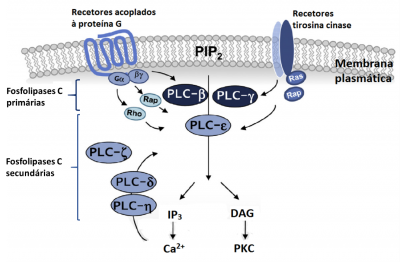
Figura 2 – Esquema que representa las diferentes fosfolipasas C, primarias y secundarias, y sus mecanismos de activación y actuación. Adaptado de Yang, Y.R. et al. (2013).
Estructura
Las fosfolipasas C son proteínas solubles con masas moleculares comprendidas entre 85 y 150 kDa. Todas las fosfolipasas tienen una estructura básica en común (ver Figura 3) que es caracterizada por la presencia de:
- Un dominio designado homología de pleckstrin (PH) en la extremidad N-terminal. Este dominio está ausente en la PLC-ζ.
- Cuatro motivos consecutivos de EF tras el dominio PH.
- El centro catalítico compuesto por un barril de triosa fosfato isomerasa (TIM). El barril TIM es compuesto por un dominio X e Y que están unidos por un linker X-Y autoinhibitorio.
- El dominio C2 en la extremidad C-terminal.
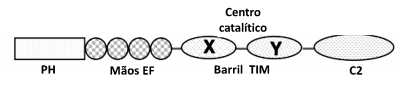
Figura 3 – Representación lineal de los diferentes dominios de la PLC-δ1. Adaptado de Rebecchi & Pentyala (2000).
References:
- Litosch, I. (2015). Regulating G protein activity by lipase-independent functions of phospholipase C. Life Sciences, 137: 116-124.
- Rebecchi, M. J., Pentyala, S.N. (2000). Structure, Function, and Control of Phosphoinositide-Specific Phospholipase C. Physiological Reviews, 80 (4): 1291-1335.
- Singh, A. et al. (2015). Plant phospholipase C family: Regulation and functional role in lipid signaling. Cell Calcium, 58: 139-146.
- Yang, Y.R. et al. (2013). The physiological roles of primary phospholipase C. Advances in Biological Regulation, 53: 232–241.




