As lipoproteínas desempenham diferentes funções fisiológicas:
- Os Quilomicrons são “destruídos” nos capilares dos tecidos periféricos: os quilomicrons são estruturados a partir da mucosa intestinal e funcionam para manter os triacilgliceróis e o colesterol exógenos suspensos em solução aquosa. Estas lipoproteínas são libertadas para a linfa intestinal (designada/conhecida como quilo), sendo transportadas através dos vasos linfáticos antes de serem drenadas para as “grandes” veias do corpo através do ducto torácico. Ainda assim, os quilomicrons têm a capacidade de aderir aos locais de ligação da superfície interna (endotélio) dos capilares no músculo-esquelético e do tecido adiposo. Poucos minutos após os triacilgliceróis entrarem na corrente sanguínea, sendo estes um dos componentes dos quilomicrons são então hidrolisados através da ação de uma enzima extracelular a lipase de lipoproteína (LPL) que é ativada pela apoC-II. Assim, como os triacilgliceróis, os quilomicrons são progressivamente hidrolisados sendo reduzidos a quilomicrons denominados de quilomicrons “remanescentes”, enriquecidos em colesterol. Porém os quilomicrons “remanescentes” podem reinserir-se na circulação sanguínea através da dissociação a partir do endotélio capilar e são subsequentemente absorvidos pelo fígado. Por conseguinte, os quilomicrons podem fornecer os triacilgliceróis para os tecidos muscular e adiposo e o colesterol para o fígado.
- A degradação das lipoproteínas de muito baixa densidade (VLDL) é muito semelhante à dos quilomicrons: As VLDL são sintetizadas no fígado como veículos de transporte de lípidos, sendo também degradadas por uma lipase lipoproteica. No entanto, os “remanescentes” de VLDL aparecem na circulação sanguínea primeiro como lipoproteínas de densidade intermédia (IDL) e depois como lipoproteínas de baixa densidade (LDL). Na transformação das VLDL para LDL, todas as proteínas (apoB-100) são removidas e grande parte do colesterol é esterificado pela enzima lectina-colesterol aciltransferase (LCAT) associada às lipoproteínas de alta densidade (HDL). Esta enzima transfere assim um resíduo de ácido gordo a partir do átomo de C2 da lectina para o colesterol dando origem à formação concomitante de lisolecitina. A apoB-100 é uma glicoproteína monomérica com 4536 resíduos (é assim, uma das maiores proteínas monoméricas conhecidas), possuindo uma hidrofobicidade que se aproxima das proteínas integrais, contendo relativamente poucas hélices anfipáticas. Ainda assim, cada partícula de LDL contém uma molécula de apoB-100, que através de imunomicroscopia indica ter uma forma alargada que cobre pelo menos metade da superfície da partícula. Todavia, os quilomicros contêm a apoB-48 (possuí 2152 resíduos) que é idêntica, em 48 %, à sequência N-terminal da apoB-100, em que, ambas as proteínas são codificadas pelo mesmo gene, sendo este um mecanismo notável, uma vez que este gene expressa proteínas com comprimentos diferentes no fígado e nos intestinos.
- As células absorvem o colesterol através da endocitose de LDL: o colesterol é um componente essencial das membranas celulares de origem animal e pode ser fornecido externamente, no entanto, se esta fonte for insuficiente ele é também sintetizado de forma interna. Após vários estudos, conseguiu-se demostrar que as células obtêm colesterol exógeno através do mecanismo de endocitose de LDL em complexos com recetores de LDL (LDLR) a partir da ligação específica de uma glicoproteína transmembranar que se encontra na superfície celular e a apoB-100. Por outro lado, as moléculas de LDL também se ligam aos quilomicrons “remanescentes” através dos seus componentes de apoE.
- O Domínio de ligação do recetor da ApoE contém um cluster de 4 hélices: a ApoE é uma proteína monomérica com 299 – resíduos, que consiste em dois domínios dobrados de uma forma independente: um domínio N-terminal que se liga fortemente à LDLR mas fracamente ao lípido e um domínio C-terminal que se liga à superfície da lipoproteína, no entanto, sem afinidade para a LDLR. A proteólise da apoE produz dois fragmentos: o domínio N-terminal (1-191 resíduos) e o domínio C-terminal (216-299 resíduos) que é maioritariamente constituídos por hélices. Porém, o LDLR liga-se a apoB-100 e a apoE com afinidades comparáveis, no entanto, a apoB-100 (mas não a apoB-48) contém um segmento extremamente semelhante à hélice de ligação ao recetor da apoE. No entanto, no caso da VLDL, o domínio de ligação ao recetor na apoB-100 não está disponível para promover a ligação ao recetor, contudo este domínio é exposto na transformação de VLDL para LDL.
- As HDL transportam o colesterol dos tecidos para o fígado: A HDL tem essencialmente uma função oposta à LDL, pois este promove a remoção do colesterol dos tecidos e é obtido em grande parte no plasma sanguíneo através da degradação de outras lipoproteínas. Na circulação sanguínea a HDL capta o colesterol extraindo-o a partir da superfície celular das membranas e convertendo-o em ésteres de colesterol sob ação da LCAT (enzima ativada pela apoA-I). Portanto, a HDL funciona como uma molécula com a capacidade de capturar colesterol. O fígado é o único órgão capaz de libertar quantidades significativas de colesterol através da sua conversão em ácidos biliares.
Outros assuntos relacionados:
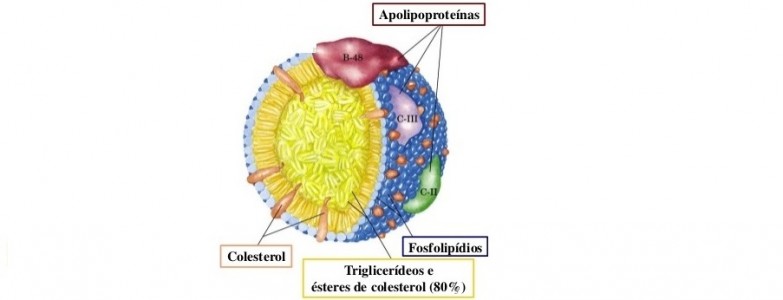
- Estrutura das lipoproteínas;
- Disfunção de lipoproteínas na aterosclerose;
- Propriedade dos lípidos;
- Classificação dos lípidos.
13598 Visualizações 1 Total
References:
- Vance, D.E. and Vance J.E. (Eds.), Biochemistry of Lipids, Lipoproteins, and Membranes (5th ed.), Elsevier (2008).
- Borhani, D.W., Rogers, D.P., Engler, J.A., and Brouillette, C.G., Crystal structure of truncated human apolipoprotein A-I suggests a lipid-bound conformation, Natl. Acad. Sci. 94, 12291–12296 (1997).