Fluorescência pode ser definida como a capacidade de uma substância, exposta a radiações UV, raios X ou catódicos, de emitir luz.
A fluorescência ocorre muito rapidamente depois da excitação (entre 10-6 e 10-9 s) não sendo possível para o olho humano registar a fluorescência depois da remoção da fonte de excitação. Como a fluorescência ocorre a partir do nível mais baixo do estado excitado, o espectro de fluorescência é independente do comprimento de onda de excitação. A intensidade da radiação emitida é proporcional à radiação de excitação (isto é ao número de fotões absorvidos).
Técnicas de análise baseadas em fluorescência são extremamente sensíveis e vastamente aplicadas.
Em princípio, qualquer molécula capaz de absorver radiação ultravioleta pode fluorescer. Quanto maior é a absorção pela molécula, maior a intensidade da sua fluorescência. Muitos compostos aromáticos e heterocíclicos fluorescem, particularmente quando contêm certos grupos. Compostos com ligações duplas conjugadas têm uma elevada probabilidade de fluorescer. Compostos que contém um ou mais grupos doadores de eletrões, como por exemplo, -OH, -NH2, e -OCH3, têm probabilidade de fluorescência maior.
A fluorescência de muitas moléculas depende do valor do pH do seu ambiente, em determinados casos, somente a sua forma ionizada (ou não ionizada) fluoresce (por exemplo, a molécula fenol C6H5OH, fluoresce mas o seu anião não fluoresce).
Uma molécula que não fluoresce pode ser convertida para um derivativo fluorescente. A modificação de moléculas de interesse biológico para se tornarem fluóforos tem tido uma contribuição importante na análise clínica e estudo de muitas doenças.
Instrumentação
Para estudar a fluorescência de uma amostra é necessário separar a radiação emitida da radiação absorvida para excitar a substância. A maneira mais satisfatória de atingir este fim é medir a fluorescência a 90º da radiação incidente. A radiação de fluorescência propaga-se em todas as direções mas a radiação incidente passa através da amostra numa direção só.
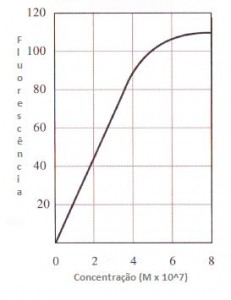
Segue um gráfico com a variação típica da fluorescência de acordo com a concentração da amostra.
Em geral, moléculas que fluorescem absorvem radiação ultravioleta de uma gama de comprimentos de onda, portanto uma fonte simples é suficiente para a maioria de aplicações. A fonte mais comum é a lâmpada de vapor de mercúrio. Uma fonte alternativa, mais sofisticada, é a lâmpada de xenon. A vantagem principal desta fonte é que pode ser usada para fornecer uma gama relativamente grande de comprimentos de onda na zona ultravioleta do espectro.
Podemos compreender por que é que as técnicas fluorimétricas são tão sensíveis se as compararmos com os métodos de espectroscopia de absorção. Nos métodos de absorção avalia-se a diferença entre dois sinais, Io e I, e a sensibilidade do instrumento depende da sua estabilidade. No caso de fluorimetria, mede-se a diferença entre zero e o sinal obtido, e o limite de deteção depende da intensidade da fonte, da sensibilidade e da estabilidade do detetor. Além de uma sensibilidade superior, a técnica de fluorimetria tem a vantagem de detetar uma gama muito maior de concentrações de amostra.
Um espectroflurímetro possui dois monocromadores, um para selecionar o comprimento de onda de excitação e o outro para seleccionar o comprimento de onda de fluorescência (deteção). Como a intensidade da fonte pode variar de um dia para outro normalmente o instrumento é calibrado medindo a intensidade da fluorescência de uma amostra padrão e ajustando o instrumento para dar o mesmo valor. A amostra mais comumente usada em calibração é uma solução de quinona em ácido sulfúrico diluído.
Esta técnica é certamente uma das mais importantes disponíveis no laboratório de Química Analítica. Os dois aspetos práticos que mais contribuem para a importância desta técnica em termos comerciais são a seletividade e sensibilidade. É uma das técnicas com limites de deteção mais baixos para amostras provenientes de produtos alimentares, farmacêuticos, clínicos e ambientais/naturais.