El Adenilato ciclasa (EC 4.6.1.1) es una enzima que cataliza formación de cAMP (adenosina monofosfato cíclico) a partir de ATP (adenosina trifosfato).
El adenilato ciclasa sintetiza cAMP
El Adenilato ciclasa es una enzima que se encuentra en la membrana plasmática de una amplia variedad de células. Esta enzima cataliza la conversión de la ATP en cAMP y también en pirofosfato (PPi) como subproducto de la reacción (ver Figura1).
La activación de esta enzima tiene como consecuencia el aumento de la concentración del cAMP en el interior de la célula. El cAMP es un segundo mensajero que posibilita la transmisión de la señal de una hormona (primero mensajero) para dentro de la célula.
El adenilato ciclasa interviene en la señalización intracelular
Las hormonas son elaboradas por células endocrinas y lanzadas para la circulación sanguínea hasta alcanzar las células objetivo. Algunas hormonas son incapaces de entrar en el interior de la célula. Unas veces debido a su tamaño, otras debido a su solubilidad, las hormonas generalmente proteicas, no atraviesan la membrana plasmática. En vez de eso, estas hormonas se unen a proteínas receptoras situadas en la superficie externa de la membrana plasmática de la célula objetivo.
Cuando es efectuada la unión de la hormona con su receptor, la proteína G es activada. Esta proteína intermedia el receptor y el adenilato ciclasa. La proteína G activada se une al adenilato ciclasa y, ésta, a su vez, es estimulada para convertir el ATP en cAMP.
El cAMP producido, a su vez, se va a unir a la cinasa A, una enzima que se encuentra en el citoplasma. A su vez, la cinasa A activada va a fosforilar otras proteínas de la célula, estimulando o inhibiendo vías metabólicas celulares.
El cAMP producido va a acabar por ser degradado por la enzima cAMP fosfodiesterasa a apenas AMP. Y, así, el estímulo provocado por este segundo mensajero es disipado.
| Señalización celular interna vía del cAMP | ||||
| (1) Enlace de una hormona a su receptor | → | (2) Activación de la proteína G | → | (3) Activación del adenilato ciclasa |
| ↓ | ||||
| (6) Fosforilación de proteínas | ← | (5) Activación de la cinasa A | ← | (4) Síntesis de cAMP |
Estructura del adenilato ciclasa
La estructura típica del adenilato ciclasa es compuesta por cinco dominios (ver Figura 2):
- El primer dominio es el terminal amina (NH2);
- Un dominio transmembranar hidrofóbico (TM1) constituido por seis hélices transmembranares;
- Un dominio citoplasmático (C1) y dividido en C1a e C1b;
- Un segundo transmembranar (TM2) también constituido por seis hélices;
- Un segundo dominio citoplasmático (C2) y dividido en C2a e C2b.
Los dominios citoplasmáticos (C1 e C2) constituyen el centro catalítico y están sujetos a la regulación intracelular. Las regiones C1a e C2a son altamente conservadas y sirven de lugar de enlace al ATP, cuando dimerizan forman el centro catalítico. Los dominios C1b y C2b son regiones menos conservadas.
Clasificación de los diferentes adenilato ciclasas
Son conocidas seis clases de adenilato ciclasa:
- La clase I es encontrada en E. coli y otras bacterias gram-negativas;
- La clase II forma un grupo de toxinas secretadas por agentes patogénicos como Pseudomonas aeruginosa y Bordetella pertussis y son transportadas para las células huésped perturbando la señalización intracelular;
- La clase III es ubicua, pues incluye todos los adenilato ciclasas encontrados en los eucariotas y de muchos procariotas. En los mamíferos, por lo menos diez isoformas del adenilato ciclasa (AC1 a AC10) fueron clonados y caracterizados. Todos ellos pertenecen a la clase III. Las nueve primeras son transmembranares y la AC10 es soluble.
- Las Clases IV-VI fueron definidas recientemente y hasta ahora comprenden apenas uno o pocos miembros procariotas.

Figura 1 – Conversão do ATP em cAMP catalisada pela adenilato ciclase. Adaptado de Steer (1975).
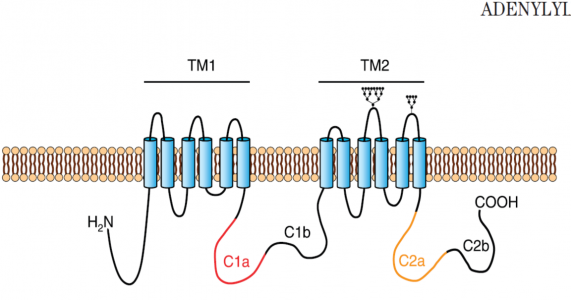
Figura 2 – Estrutura da adenilato ciclase. Adaptado de Willoughby & Cooper (2007).
References:
- Cooper, G. M., & Hausman, R. E. (2013). The cell: A molecular approach (6th ed.). Sunderland, MA: Sinauer Associates.
- Hanoune, J., Defer, N. (2001). Regulation and Role of Adenylyl Cyclase Isoforms. Annu. Rev. Pharmacol. Toxicol., 41: 145-174.
- Hurley, J. H. (1999). Structure, Mechanism, and Regulation of Mammalian Adenylyl Cyclase. THE Journal of Biological Chemistry, 274(12): 7599–7602.
- Sabbatini, M. E., Gorelick, F., Glaser, S. (2014). Adenylyl cyclases in the digestive system. Cellular Signalling, 26: 1173–1181.
- Steegborn, C. (2014). Structure, mechanism, and regulation of soluble adenylyl cyclases — similarities and differences to transmembrane adenylyl cyclases. Biochimica et Biophysica Acta, 1842: 2535–2547.
- Steer, M. L. (1975). Adenyl Cyclase. Ann. Surg., 182 (5): 603-609.
- Willoughby, D., Cooper, D. M. F. (2007). Organization and Ca2_ Regulation of Adenylyl Cyclases in cAMP Microdomains. Physiol Rev, 87: 965–1010.




