A integrina refere-se a um grupo de proteínas recetoras que se liga a proteínas específicas na matriz extracelular e a proteínas membranares nas células adjacentes e tem como função estrutural ancorar a célula à matriz ou a outra célula. Além disso, as integrinas são capazes de transmitir sinais para o interior da célula.
Estrutura
As integrinas (ver Figura 1) são heterodímeros proteícos, isto é, são constituídas por dois blocos diferentes. Estes dois blocos são as subunidades α e β que estão ligadas não covalentemente.
Nos vertebrados, existem 18 subunidades α e 8 β que se podem associar num total de 24 combinações diferentes, formando recetores com diferentes afinidades e que são distribuídos pelos tecidos de forma diferente.
Cada subunidade pode ser dividida em três partes:
a) um grande ectodomínio – a parte das integrinas que está exposta ao exterior da célula;
b) uma única hélice que atravessa a membrana plasmática;
c) um domínio citoplasmático que consiste numa cauda citoplasmática curta;
O peso molecular de cada subunidade pode variar entre 90 a 160 kDa.
As integrinas e a adesão celular
As integrinas fazem parte de um grupo de proteínas membranares chamadas de moléculas de adesão celular (CAMs). As CAMs de uma célula ligam-se às CAMs de outra célula adjacente, mediando as adesões celulares.
Para além das integrinas, as principais famílias de moléculas de adesão celular incluém as caderinas, as selectinas e a superfamília de imunoglobulinas.
As integrinas funcionam como moléculas de adesão celular ou como recetores de adesão que se ligam a uma grande quantidade de proteínas multiadesivas da matriz extracelular como, por exemplo, a fibronectina.
As integrinas possibilitam a adesão celular e o envio bidirecional de sinais
As integrinas são recetores transmembranares que funcionam como pontes que estabelecem a ligação entre a matriz extracelular com o citosqueleto no interior da célula.
A parte das integrinas que está exposta ao exterior da célula (o ectodomínio) liga-se a elementos específicos da matriz extracelular (tais como o colagénio, a fibronectina, a lamimina, etc.) ou da superfície de células vizinhas. Já a parte das integrinas que está exposta ao interior da célula (o domínio citoplasmático) associa-se aos microfilamentos que constituem o citosqueleto de actina através do auxílio de proteínas sinalizadoras.
Assim, as integrinas permitem o estabelecimento de uma sinalização transmembranar bidireccional dinâmica que é essencial para a regulação da adesão e da mobilidade celular.
Quando as integrinas se ligam a ligandos extracelulares, enviam sinais para o interior da célula através de uma via de reações bioquímicas. É a sinalização de fora para dentro (outside-in signaling) que permite detetar parte da composição química da matriz extracelular e a sua força mecânica.
Ativação
A integrina não apresenta atividade enzimática. O seu mecanismo de ação depende da indução de uma alteração da sua forma.
Na ativação da integrina, são os ectodomínios que sofrem uma alteração conformacional que aumenta a sua afinidade para o ligando da matriz extracelular. Simultaneamente, a ativação deste recetor envolve a separação dos domínios transmembranar e citoplasmático das duas subunidades (α e β).
Pensa-se que a alteração conformacional da integrina seja consequência da ligação da proteína citoplasmática, a talina, à cauda citoplasmática da subunidade β (ver figura 1). O domínio em forma de bastonete da talina liga-se depois aos microfilamentos de actina, promovendo a interação com o citosqueleto.
Outra proteína citoplasmática, a kindlina, interage com a talina depois desta se ligar à subunidade β da integrina. A talina e a kindlina são chamadas ativadores da integrina.
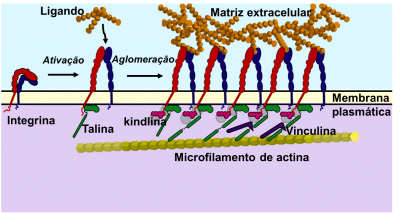
Figura 1 – Ativação e aglomeração da integrina e os componentes a que se liga. Adaptado de Iwamoto & Calderwood, 2015.
References:
- Campbell, I.D. & Humphries, M.J. (2011).Integrin Structure, Activation, and Interactions. Cold Spring Harb Perspect Biol, 3:a004994.
- Chen, C. et al., (2016). Integrins and integrin-related proteins in cardiac fibrosis. Journal of Molecular and Cellular Cardiology, 93:162–174.
- Iwamoto, D.V. Calderwood, D.A. (2015). Regulation of integrin-mediated adhesions. Current Opinion in Cell Biology, 36:41–47.





