Conceito de pH
O pH é um número adimensional, que a 25 °C varia de 0 a 14 e que indica o grau de acidez de soluções aquosas. Esse número é obtido a partir do logaritmo negativo da concentração (ou da atividade, em sua forma mais precisa) de íons H+ na solução. Quanto menor o valor do pH mais ácida é a solução. Valores de pH menores que 7 indicam meio ácido, maiores que 7 indicam meio básico e o valor 7 indica meio neutro.
O conceito de pH apareceu pela primeira vez em 1909 em um artigo publicado na revista alemã Biochemische Zeitschrift intitulado Über die Messung und die Bedeutung der Wasserstoffionenkonzentration bei Enzimatischen Prozessen (Sobre a Medição e o Significado da Concentração do Íon Hidrogênio em Processos Enzimáticos) de autoria de Soren Peter Lauritz Sörensen, quando trabalhava nos laboratórios Carlsberg, Copenhagen. Como bioquímico, ele estava interessado em avaliar a influência da concentração de íons H+ (isto é, a acidez do meio) no comportamento de enzimas. Normalmente a acidez das soluções é determinada por meio de titulação ácido-base, mas esse método apresentava dois inconvenientes: baixa precisão para concentrações reduzidas de H+ e alteração do comportamento enzimático por adição de uma base. Sörensen propôs um método alternativo para avaliar a concentração de íons hidrogênio, que resolvia os dois inconvenientes. O grau de acidez de soluções poderia ser expresso através de uma relação matemática envolvendo a concentração do íon hidrogênio (H+), determinada por potenciometria.
Sörensen considerou inicialmente o equilíbrio químico de ionização da água:
![]()
Em 1909 os símbolos das grandezas químicas não eram todos iguais aos que usamos hoje em dia. Sörensen adotou a letra C maiúscula para representar a concentração em mol/L das espécies em equilíbrio:

No estado de equilíbrio, temos:
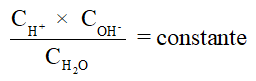
No meio aquoso a concentração da água é constante, logo, a equação acima pode ser simplificada para conter uma única constante:
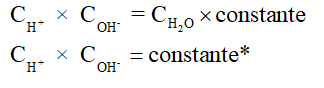
A constante sinalizada com * na relação acima é chama constante de ionização da água. Usando símbolos atuais, ela é representada por Kw e as concentrações em mol/L são representadas por colchetes contendo a fórmula de cada espécie:
Kw = [H+] × [OH–]
O valor de Kw é afetado pela temperatura da solução. Medidas experimentais indicam que, a 25°C, dentro de certa margem de precisão, essa constante vale 10-14.
Kw = [H+] × [OH–] = 10-14 (a 25°C)
Íons H+ aumentam a acidez das soluções aquosas, enquanto íons OH– aumentam sua alcalinidade. Para que o meio aquoso seja neutro, as concentrações desses íons devem ser iguais. Aplicando isto à relação acima chegamos a:
[H+] = [OH–] = 10-7 mol/L (para meio neutro a 25 °C)
Para que o meio seja ácido, [H+] deve ser maior que [OH–], o que nos leva às situações descritas na tabela a seguir:
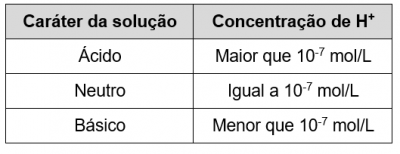
A tabela acima mostra a relação direta entre a concentração de íons H+ e o caráter ácido-básico das soluções aquosas. Se, por exemplo, em determinada solução aquosa [H+] = 10-4 mol/L (maior que 10-7 mol/L) então essa é uma solução ácida.
Sörensen propôs que o expoente da concentração de íons H+ seria suficiente para expressar o grau de acidez das soluções. Esse expoente é obtido extraindo-se o logaritmo negativo da concentração de íons H+. Essa foi a definição de Sörensen para a grandeza pH:
“pH é um número que corresponde ao logaritmo negativo da concentração de íons hidrogênio.”
Ou seja:
![]()
Para [H+] = 10-4 mol/L, pH = – log 10-4 = 4
Para [H+] = 10-8 mol/L, pH = – log 10-8 = 8
E assim por diante. Note que [H+] = 10-pH mol/L.
Veremos adiante que essa definição precisou ser aperfeiçoada para que o pH pudesse ser adequadamente usado em uma série de situações não consideradas inicialmente.
Uma consequência do que foi exposto acima é que quanto mais ácida uma solução aquosa, menor o seu pH.
![]()
Da mesma forma, define-se a grandeza pOH:
pOH = – log [OH–]
Da relação [H+] × [OH–] = 10-14 (a 25 °C) demonstra-se que:
pH + pOH = 14 (a 25 °C)
Exemplos de Cálculos de pH para soluções aquosas
Caso 1: HCℓ 0,001 mol/L completamente ionizado.
HCℓ → H+(aq) + Cℓ–(aq)
Trata-se de um monoácido, portanto:
[H+] = [HCℓ] = 0,001 mol/L = 10-3 mol/L
pH = – log 10-3 = 3
Caso 2: H2SO4 0,001 mol/L completamente ionizado.
H2SO4 → 2 H+(aq) + SO(aq)
Trata-se de um diácido, portanto:
[H+] = 2 × [H2SO4] = 0,002 mol/L = 2 × 10-3 mol/L
pH = – log (2 × 10-3)
= – (log 2 + log 10-3)
= – (0,3 – 3) = 2,7
Caso 3: NH4OH 0,02 mol/L 3% ionizado.
NH4OH → NH(aq) + OH–(aq)
[OH–] = 3% da [NH4OH] = 0,03 × 0,02 = 0,0006 = 6 × 10-4 mol/L
pOH = – log (6 × 10-4)
= – (log 6 + log 10-4)
= – (0,78 – 4) = 3,22
pH = 14 – 3,22 = 10,78
O Método Experimental de Sörensen para Medidas de Acidez e a Origem do pH
No artigo original de 1909, Sörensen propôs a utilização de um eletrodo de hidrogênio (H+/Pt/H2) para as medidas experimentais da acidez das soluções ao invés da tradicional titulação ácido-base. O potencial eletroquímico desse eletrodo é dado pela equação:

ou: E = 0,0577 × ( – log[H+] )
Ou seja, a ddp da célula era proporcional ao termo – log [H+]. Sörensen então propôs que era conveniente usar apenas esse termo como uma medida indireta do grau de acidez das soluções. Foi esse termo que ele chamou de pH.
A Origem do símbolo pH
Em livros didáticos de vários idiomas encontramos versões para a origem do símbolo “pH”. É comum a sugestão de que se trata de uma sigla para “potencial hidrogeniônico”, talvez pelo fato de que as medidas experimentais de acidez, como já citamos acima, eram feitas a partir do potencial de uma célula eletroquímica. Algumas publicações citam, alternativamente, o fato de que Sörensen usava as letras p e q para se referir à solução aquosa de concentração desconhecida (solução p) e à solução de referência (solução q) e que o símbolo pH significaria a concentração de H+ da solução analisada (solução p). Há também referências ao fato de que nos laboratórios Carlsberg, onde Sörensen trabalhava, falava-se francês e a letra p seria uma abreviação de puissance (potência, em francês). Ou ainda: o símbolo seria abreviação de pondus Hidrogenii (potencial de hidrogênio, em latim). Todas essas versões, no entanto, são fruto de especulação. Essas múltiplas versões levam alguns autores a supor inclusive que a escolha de Sörensen tenha sido simplesmente aleatória.
Por que não consultamos o próprio Sörensen? No artigo de 1909, a palavra que dá origem ao símbolo p é potenz (expoente, em alemão). Na página 134 dessa publicação, encontramos a explicação pessoal de Sörensen para a escolha do símbolo pH. Reproduzimos a seguir um print dessa página do artigo, com o parágrafo em que o símbolo aparece pela primeira vez na história da química (grifos desse autor):

Em português:
A magnitude da concentração de íons hidrogênio pode ser convenientemente representada por meio de um fator normalizado em relação ao íon hidrogênio, e este fator será escrito na forma de um expoente negativo de 10. Já que voltarei a esse ponto em uma secção adiante (ver pág, 159), aqui mencionarei apenas que eu emprego o nome “expoente do íon hidrogênio” e o símbolo pH para o valor numérico dessa potência.
(Tradução desse autor)
Note que a primeira versão do símbolo não era pH, mas sim pH. Esperamos que o “testemunho” do próprio Sörensen seja suficiente para dirimir qualquer dúvida a respeito da origem desse símbolo. Embora não haja no artigo de 1909 nenhuma frase explícita, como “eu escolhi a letra p como referência à palavra potenz”, ainda assim nos parece inevitável estabelecer essa relação, dada à construção do parágrafo mostrado no print além de outros trechos do artigo, no qual o valor de [H+] é escrito como 10-p. Em artigos posteriores aparecem outras variantes, como Ph e sendo o formato pH, que utilizamos atualmente, tornado oficial a partir de sua ampla utilização em artigos publicados posteriormente pela revista Journal of Biological Chemistry.
A Definição IUPAC para pH
A definição inicial de pH proposta por Sörensen funcionava bem para seus propósitos iniciais como bioquímico e dentro do conceito de Arrhenius para ácidos e bases. Uma série de observações experimentais posteriores demonstrou haver várias situações em que o valor de pH observado experimentalmente era muito diferente do obtido pelo cálculo direto através da fórmula pH = – log [H+].
As inconsistências surgem do fato de que a medição potenciométrica da concentração de íons H+ não detecta a concentração, mas sim a atividade dos íons H+. Entende-se por atividade a “concentração efetiva” de uma espécie, ou seja, o valor de concentração que realmente expressa quantitativamente as propriedades químicas dessa solução. Por várias razões, o valor da atividade, a é menor que o da concentração, C. A atividade é obtida por:
![]()
onde é o coeficiente de atividade, um número adimensional que teoricamente varia de 0 a 1, sendo 1 a situação ideal em que a concentração se iguala à atividade. As inconsistências observadas nas medições de pH são resolvidas quando se substitui [H+] pela atividade dos íons H+. Esta alteração foi proposta pelo próprio Sörensen e constitui a definição de pH adotada pela IUPAC:
![]()
Para exemplos de situações em que o uso de [H+] implica em inconsistências entre o valor calculado para o pH e o valor determinado experimentalmente, recomendamos a leitura do excelente artigo de McCarty e Vitz (2006), que consta de nossas referências.
References:
Buck, R. P., et al. “Measurement of pH. Definition, standards, and procedures (IUPAC Recommendations 2002). ” Pure and Applied Chemistry 74.11 (2002): 2169-2200.
Jensen, W. B. “The symbol for pH.” Journal of Chemical Education 81, 1 (2004): 21.
McCarty, C. G and Vitz, E. “pH Paradoxes: Demonstrating That It Is Not True That pH≡-log [H+].” Journal of Chemical Education 83, 5 (2006): 752.
Sørensen, S.P.L., “Enzymstudien II: Uber die Messung und die Bedeutung der Wasserstoffionenkonzentration bei enzymatischen Prozessen,” Biochem. Zeit, 1909, 21, 131- 200.




