Conceito de regra de Markovnikov
A regra de Markovnikov é uma regra que permite prever qual produto será obtido em reações de adição de haletos de hidrogênio a alcenos (p.e. adição de HBr ao propeno). Nessas reações o átomo de hidrogênio é adicionado preferencialmente ao átomo de carbono da ligação dupla que possui maior número de átomos de hidrogênio. Após avanços no estudo do mecanismo dessas reações, foi estabelecido o enunciado moderno dessa regra, que permite prever o produto principal da adição mesmo nos casos em que o composto adicionado não possui átomos de hidrogênio (p.e. adição de ICℓ).
Em 1870 o químico russo Vladimir Vasilyevich Markovnikov (transliteração do cirílico Владимир Васильевич Марковников), estabeleceu a partir de um grande número de observações experimentais, aquilo que é conhecido como a regra de Markovnikov:
Em reações de adição de haletos de hidrogênio a alcenos, o átomo de hidrogênio é adicionado preferencialmente ao átomo de carbono mais hidrogenado da ligação dupla.
Mnemonicamente: “Hidrogênios procuram hidrogênios.”
A adição de brometo de hidrogênio ao propeno ilustra essa regra:
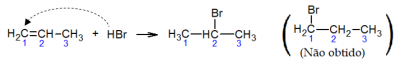
No exemplo acima o átomo de hidrogênio foi adicionado ao carbono 1 da cadeia. O composto mostrado entre parênteses, no qual o hidrogênio é adicionado ao carbono 2, não é obtido ou é obtido em quantidades desprezíveis.
O rendimento da adição de HX a alcenos aumenta com a redução da eletronegatividade do halogênio, ou seja:
HI > HBr > HCℓ
Para HBr e HCℓ a reação pode ser tão lenta a ponto de se tornar inviável. Pode-se, no entanto, aumentar a velocidade dessas reações conduzindo-as em presença de sílica gel ou alumina, usando CH2Cℓ2 como solvente.
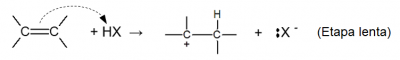
Estudos posteriores mostraram que essas reações ocorrem por um mecanismo em duas etapas:
Etapa 1: elétrons π da ligação dupla recebem o íon H+ do haleto formando um carbocátion:
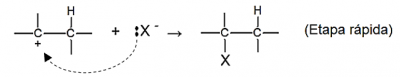
Etapa 2: O carbocátion formado estabiliza-se ligando-se ao ânion haleto gerado na primeira etapa:
No mecanismo que vimos acima, a primeira etapa é a determinante para a velocidade do processo, pois é a mais lenta. Nessa etapa, podemos considerar a formação de dois carbocátions diferentes, já que a carga elétrica positiva pode se localizar, teoricamente, nos dois carbonos da ligação dupla. Tomemos o propeno como exemplo:
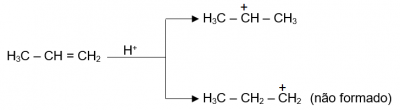
A razão pela qual o segundo carbocátion não é formado é que a variação da energia livre (ΔG°), ou seja, a energia de ativação para a sua formação, é maior, pois seu estado de transição é mais instável.
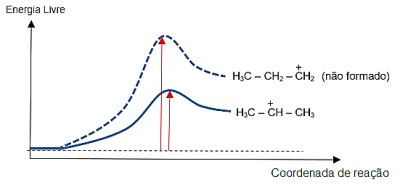
Observa-se que a estabilidade do carbocátion está diretamente relacionada ao tipo de carbono onde a carga positiva se localiza:
Terciário > Secundário > Primário
Note que no diagrama de energia acima, o carbocátion não formado tem sua carga elétrica localizada em um carbono primário, enquanto no outro, mais estável, localiza-se no carbono secundário.
A compreensão do mecanismo em duas etapas das reações de adição permitiu reescrever a regra de Markovnikov em sua forma moderna, para uma aplicação mais ampla:
Na adição em alcenos, a parte menos eletronegativa do reagente adicionado será adicionada ao carbono da dupla ligação que dá origem ao carbocátion mais estável na primeira etapa da reação.
Note que essa forma mais moderna para a regra de Markovnikov permite predizer o produto principal obtido mesmo quando o reagente adicionado não inclui o hidrogênio. Vejamos o exemplo da adição de cloreto de iodo (ICℓ) ao metilpropeno:
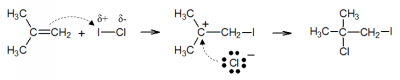
O iodo é menos eletronegativo que o cloro, por isso, na primeira etapa, ele é adicionado ao carbono mais hidrogenado da ligação dupla, de modo a permitir a formação da carga positiva no carbono terciário (carbocátion mais estável).
Até o início da década de 1930 eram comuns relatos de reações de adição que aparentemente não obedeciam a regra de Markovnikov. Em alguns casos, o mesmo cientista obtinha diferentes resultados usando as mesmas condições em diferentes ocasiões. Essa aparentemente aleatoriedade foi explicada em 1933 pela regra de Kharasch.
References:
Solomons, T. W. G. (1994) Fundamentals of Organic Chemistry (4th ed., pp.342-347). United States of America: John Wiley & Sons, Inc.



