Concept de toxine cholérique
L’existence d’une toxine responsable des symptômes du choléra a été proposée en 1884 par Robert Koch, qui soupçonnait que l’agent responsable du choléra produisait « un poison spécial » qui agissait sur l’épithélium intestinal et que les symptômes du choléra pourraient être « considérés comme un empoisonnement ». L’existence de cette toxine hypothétique a été démontrée en 1959 par deux groupes de chercheurs indépendants qui travaillaient en Inde. De et al et Dutta et al. ont démontré qu’une perte de liquide se produisait lorsque les cultures de Vibrio cholerae filtrées ou lysées étaient introduites dans le tube digestif d’un lapin. La purification de la toxine, 10 ans plus tard par Finkelstein et LoSpalluto, a permis à de nombreux chercheurs de découvrir les propriétés fondamentales de cette toxine telles que sa structure, son récepteur et son mode d’action.
Structure de la toxine cholérique
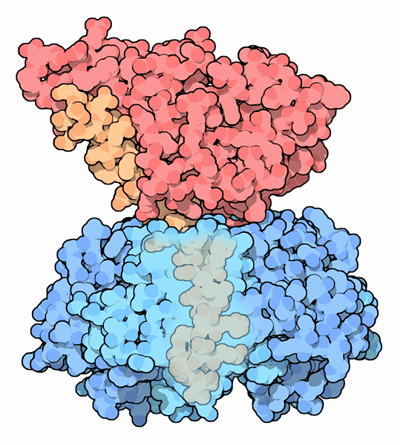
Représentation tridimensionnelle de la toxine cholérique (Goodsell, D., 2005)
La toxine cholérique (CT) est une protéine qui appartient à la famille des toxines du type A-B. La sous-unité B fonctionne comme un transporteur de l’holotoxine vers le récepteur de la cellule eucaryote et la sous-unité A possède une fonction enzymatique spécifique qui agit intracellulairement. La toxine cholérique a un poids moléculaire total d’environ 85,2 KDa. L’holotoxine A a un poids moléculaire d’environ 27,2 KDa et la sous-unité B, pour sa part, se compose de cinq chaînes polypeptidiques identiques de 11,6 KDa et 103 acides aminés chacune.
La toxine cholérique est codée par une unité de transcription, contenant le gène CtxA qui code pour la sous-unité A e le gène CtxB qui code pour la sous-unité B, présente dans le génome du phage CTXΦ (CTXphi). Les gènes du phage sont transmis au vibrion par transfert horizontal du plasmide et sont intégrés dans le génome de la bactérie, ce qui lui confère le pouvoir pathogène.
Mécanisme d’action de la toxine cholérique
La cible intracellulaire de la toxine cholérique est l’adénylate cyclase, un des plus importants systèmes de régulation des cellules eucaryotes. Cette enzyme intervient dans la conversion de l’ATP en AMP cyclique (AMPc), un messager intracellulaire crucial dans une grande variété de processus cellulaires. Normalement, l’adénylate cyclase est activée ou inactivée en réponse à divers stimuli. La régulation de l’adénylate cyclase est médiée par la protéine G, protéine qui assure la liaison de nombreux récepteurs cellulaires de surface à la protéine effectrice de la membrane plasmique. Les protéines G sont des hétérotrimères composés de trois sous-unités distinctes: a,b et γ. La protéine G spécifique impliquée dans ce cas est la protéine Gs, dont l’activation conduit à l’augmentation de l’activité de l’adénylate cyclase. La toxine cholérique catalyse le transfert d’ADP-ribose du NAD (Nicotinamide Adénine Dinucléotide) vers un résidu spécifique d’arginine de la protéine Gsa, ce qui entraîne l’activation de l’adénylate cyclase et par conséquent l’augmentation du niveau intracellulaire d’AMPc. L’AMPc active une protéine kinase AMPc-dépendante, qui mène à la phosphorylation de la protéine, à la modification du transport ionique et enfin à la diarrhée.
References:
- Faruque, S.M. and G.B. Nair. (2002). Molecular ecology of toxigenic Vibrio cholera. Microbiol. Immunol., 46 (2) : 59-66
- Lau, O.L., 2004. Vibrio cholerae : Epidemiology, ecology, evolution and climate change. Reed College, Portland, OR.
- Peterson, K.M. (2002). Expression of V. cholera virulence genes in response to environmental signals. Curr. Issues. Microbiol. 3:29-38




