La lipasa es una enzima omnipresente que hidroliza los lípidos, es decir, las grasas. Existen diversos tipos de lipasas que desempeñan un papel fundamental en el metabolismo de los lípidos. En los animales, las lipasas intervienen también en la digestión, en la absorción y en la reconstitución de la grasa.
La lipasa es una esterasa
La lipasa también llamada triacilglicerol acil-hidrolasa (E.C.3.1.1.3) y, como este nombre indica, esta enzima cataliza la hidrólisis de triglicéridos, formando glicerol y ácidos grasos libres (ver Figura 1).
Los triglicéridos son la forma más común de grasa encontrada en la naturaleza. Éstos son constituidos por un residuo de glicerol unido a tres ácidos grasos. El glicerol, que es una pequeña molécula de alcohol, se une como máximo a tres moléculas de ácidos grasos porque es constituida por un esqueleto de tres carbonos. Cada molécula de ácido graso está unida al glicerol por un enlace éster, la lipasa también es considerada una esterasa.
En este sentido, la lipasa cliva (es decir, quiebra) los enlaces ésteres que unen los ácidos grasos al glicerol, separándolos. De esta forma, los triglicéridos son el sustrato de esta enzima y el glicerol y los ácidos grasos libres son su producto.
Las lipasas son hidrolasas de serina y presentan una estructura semejante a las proteasas de serina. La consecuencia de aminoácidos en el centro catalítico es la siguiente: glicina – histidina – serina – glutamato (o aspartato) – glicina.
Las lipasas y la solubilidad
Las lipasas son enzimas especiales porque son proteínas solubles en agua (es decir, son hidrosolubles) pero actúan sobre un sustrato hidrofóbico (es decir, insoluble en agua). Además de que la reacción que catalizan, una hidrólisis, necesita moléculas de agua (ver Figura 1).
La reacción se desarrolla en la interfaz agua/sustrato insoluble, donde las lipasas hidrolizan ésteres carboxílicos a la fase acuosa.
Una alteración en la conformación de la enzima ocurre después del contacto con el sustrato insoluble en agua.
Cuando el sustrato (es decir, los lípidos triglicéridos) toma la forma de micelas, éstas extienden la interfaz agua/lípido, la enzima tiene mayor contacto con su sustrato y la reacción procede más rápidamente.
La cantidad de agua en la mezcla puede determinar la dirección de la reacción catalizada por la lipasa:
- Un exceso de agua favorece la hidrólisis de los lípidos;
- Una pequeña cantidad de agua o su falta, ocurren reacciones de esterificación y transesterificación.
Las lipasas en los mamíferos
En los mamíferos, se distinguen tres grupos de enzimas lipolíticas, éstas son lipasas aisladas:
- en el tracto digestivo;
- en los tejidos de algunos órganos como el cerebro, los músculos, las arterias, los riñones, el bazo, la lengua, el hígado y el tejido adiposo;
- y en la leche. Esta lipasa es sintetizada por las glándulas mamarias productoras de leche materna rica en lípidos.
Las lipasas asociadas a la digestión y absorción de las grasas son las más estudiadas. Entre las más importantes se encuentran las siguientes:
- La lipasa gástrica es segregada por la mucosa gástrica e hidroliza los lípidos alimentarios en el estómago. Ésta es estable y activa en valores de pH próximos de 1 y es resistente a la pepsina y otras proteasas gástricas;
- La lipasa pancreática es la principal enzima responsable por la digestión de los lípidos alimentarios, ésta actúa principalmente sobre los diglicéridos liberados por la lipasa gástrica. Es secretada en el duodeno y funciona a un pH ligeramente alcalino. Necesita un cofactor proteico llamado colipasa.
- La lipoproteína lipasa permite la hidrólisis y la absorción de los triglicéridos transportados en la sangre bajo la forma de lipoproteínas por los tejidos.
- La lipasa hepática actúa sobre las lipoproteínas en la sangre. Ésta hidroliza glicéridos, fosfolípidos y ésteres de colesterol. Puede también catalizar la transesterificación entre glicéridos.
Otras lipasas
Existen lipasas que son capaces de hidrolizar los fosfolípidos que están presentes principalmente en las membranas biológicas (y son llamadas fosfolipasas), otras de hidrolizar ésteres de colesterol (esterasa de colesterol) y otras de sintetizar ésteres.
Extracción y Aplicación
Las lipasas vegetales pueden ser fácilmente aisladas a partir de sus semillas. Sin embargo, normalmente se recurre a lipasas microbianas. La mayor parte de ellas son estables en muchos solventes orgánicos y no necesitan cofactores para ser activadas. Pueden ser usadas como hidrolasas o como catalizadores de síntesis orgánica.
Las lipasas son ampliamente utilizadas en el procesamiento de grasas y aceites, en los detergentes, en el procesamiento de alimentos, en la producción de fármacos y cosméticos, etc. La siguiente tabla resume las principales aplicaciones industriales de estas enzimas.
| Productos | Aplicación |
| Bebidas | Mejora del aroma |
| Cárnicos | Eliminación de la grasa y mejora del aroma |
| Cosméticos y perfumes | Transesterificación o esterificación para síntesis de aromas |
| Detergentes | Hidrólisis de lípidos para eliminar manchas de grasa |
| Efluentes de las industrias agroalimentarias | Biorremediación |
| Fármacos / medicamentos | Enantioseletividad, transesterificación e hidrólisis |
| Lácteos | Hidrólisis de la grasa de la leche, maduración del queso y modificación de la grasa de la mantequilla para desarrollo del aroma. |
| Aceites | Transesterificación y/o hidrólisis |
| Papel | Hidrólisis para eliminar los lípidos de la materia prima |
| Químicos | Enantioseletividad (producción de um enantiómero preferencial) |
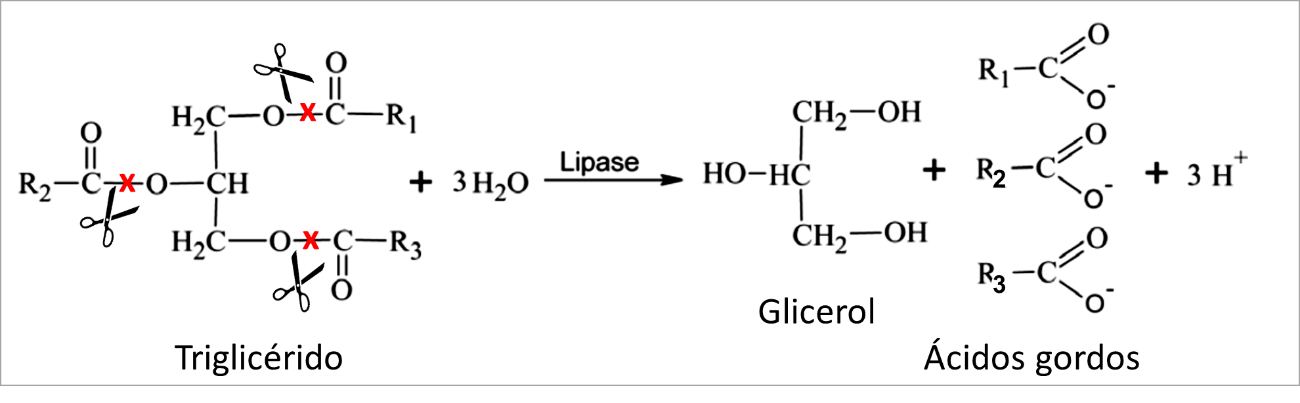
Figura 1 – Reacción de hidrólisis catalizada por la lipasa. Adaptado por Lasoń & Ogonowski (2010).
References:
- Fickers, P., Destain, J., Thonart, P. (2008). Les lipases sont des hydrolases atypiques: principales caractéristiques et applications. Biotechnol. Agron. Soc. Environ., 12 (2): 119-130.
- Lasoń, E., Ogonowski, J. (2010). Lipase – characterization, applications and methods of immobilization. CHEMIK, 64 (2): 97-102.
- Sharma, R. et al. (2001). Production, purification, characterization, and applications of lipases. Biotechnology Advances, 19: 627-662.




