Concepto de Integrina
La integrina se refiere a un grupo de proteínas receptoras que se enlaza a proteínas específicas en la matriz extracelular y a proteínas membranares en las células adyacentes y tiene como función estructural anclar la célula matriz u otra célula. Además de ello, las integrinas son capaces de transmitir señales para el interior de la célula.
Estructura de la Integrina
Las integrinas (ver Figura 1) son heterodímeros proteicos, es decir, son constituidas por dos bloques diferentes. Estos dos bloques son las subunidades α y β que están enlazadas covalentemente.
En los vertebrados, existen 18 subunidades α y 8 β que se pueden asociar en un total de 24 combinaciones diferentes, formando receptores con diferentes afinidades que son distribuidos por los tejidos de forma diferente.
Cada subunidad puede ser dividida en tres partes:
- a) un gran ectodominio – la parte de las integrinas que está expuesta al exterior de la célula;
- b) una única hélice que atraviesa la membrana plasmática;
- c) un dominio citoplasmático que consiste en una cola citoplasmática corta;
El peso molecular de cada subunidad puede variar entre 90 a 160 kDa.
Las integrinas y la adhesión celular
Las integrinas forman parte de un grupo de proteínas membranares llamadas moléculas de adhesión celular (CAMs). Las CAMs de una célula se enlazan a las CAMs de otra célula adyacente, mediando las adhesiones celulares.
Además de las integrinas, las principales familias de moléculas de adhesión celular incluyen las caderinas, las selectinas y la superfamilia de inmunoglobulinas.
Las integrinas funcionan como moléculas de adhesión celular o como receptores de adhesión que se enlazan a una gran cantidad de proteínas multiadhesivas de la matriz extracelular como, por ejemplo, la fibronectina.
Las integrinas posibilitan la adhesión celular y el envío bidireccional de señales
Las integrinas son receptores transmembranares que funcionan como puentes que establecen el enlace entre la matriz extracelular con el citoesqueleto en el interior de la célula.
La parte de las integrinas que está expuesta al exterior de la célula (el ectodominio) se enlaza a elementos específicos de la matriz extracelular (tales como el colágeno, la fibronectina, la laminina, etc.) o de la superficie de células vecinas. Sin embargo, la parte de las integrinas que está expuesta al interior de la célula (el dominio citoplasmático) se asocia a los microfilamentos que constituyen el citoesqueleto de actina a través del auxilio de proteínas señalizadoras.
Así, las integrinas permiten el establecimiento de una señalización transmembranar bidireccional dinámica que es esencial para la regulación de la adhesión y de la movilidad celular. Cuando las integrinas se enlazan a ligandos extracelulares envían señales para el interior de la célula a través de una vía de reacciones bioquímicas. Es la señalización de fuera hacia dentro (outside-in signaling) que permite detectar parte de la composición química de la matriz extracelular y su fuerza mecánica.
Activación
La integrina no presenta actividad enzimática. Su mecanismo de acción depende de la inducción de una alteración de su forma.
En la activación de la integrina, son los ectodominios quienes sufren una alteración conformacional que aumenta su afinidad para el ligando de la matriz extracelular. Simultáneamente, la activación de este receptor envuelve la separación de los dominios transmembranar y citoplasmático de las dos subunidades (α y β).
Se cree que la alteración conformacional de la integrina sea consecuencia del enlace de la proteína citoplasmática, la talina, a la cola citoplasmática de la subunidad β (ver figura 1).
El dominio en forma de bastón de la talina se enlaza después a los microfilamentos de actina, promoviendo la interacción con el citoesqueleto.
Otra proteína citoplasmática, la kindlina, interactúa con la talina después de ésta enlazarse a la subunidad β de la integrina. La talina y la kindlina son llamadas activadores de la integrina.
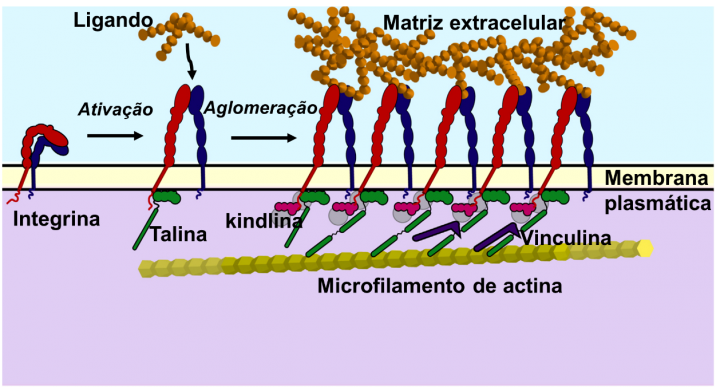
Figura 1 – Activación y aglomeración de la integrina y los componentes los que se enlaza. Adaptado de Iwamoto & Calderwood, 2015.
References:
- Campbell, I.D. & Humphries, M.J. (2011).Integrin Structure, Activation, and Interactions. Cold Spring Harb Perspect Biol, 3:a004994.
- Chen, C. et al., (2016). Integrins and integrin-related proteins in cardiac fibrosis. Journal of Molecular and Cellular Cardiology, 93:162–174.
- Iwamoto, D.V. Calderwood, D.A. (2015). Regulation of integrin-mediated adhesions. Current Opinion in Cell Biology, 36:41–47.




