Las proteínas tirosina quinasa (o tirosina quinasa), abreviado PTK, son un grupo de enzimas que catalizan la transferencia de un grupo fosfato de la molécula de ATP para un residuo de tirosina presente en un sustrato proteico.
La fosforilación de residuos de tirosina modula la actividad enzimática y crea lugares de unión para el reclutamiento de proteínas de señalización posterior.
Existen dos clases de proteínas tirosina quinasa:
- Los receptores de tirosina quinasa que son proteínas transmembranares localizadas en la membrana plasmática;
- Las proteínas no receptoras de tirosina quinasa.
En el genoma humano existen 58 tipos de receptores y 32 tipos no receptores.
Receptores de tirosina quinasa
Los receptores de tirosina quinasa (RTK) son glicoproteínas trasmembranares que son activadas por la unión de sus respectivos ligandos en la superficie de la célula y que, consecuentemente, transmiten la señal extracelular para el citoplasma a través de la fosforilación de los residuos de tirosina en los propios receptores (autofosforilación) y de las proteínas de señalización posterior.
La gran mayoría de este tipo de receptor existe como una única cadena polipeptídica y se presenta en el estado monomérico en la ausencia de ligando (ver Figura 1).
La unión a una molécula señalizadora induce a la dimerización de los receptores y a la autofosforilación de los residuos de tirosina en los dominios citoplasmáticos del propio receptor.
Los receptores tirosina quinasa activan numerosas vías de señalización dentro de las células que conducen a la proliferación, a la diferenciación y a la migración celular o a alteraciones metabólicas.
Este grupo de receptores incluye receptores para la insulina y para factores de crecimiento.
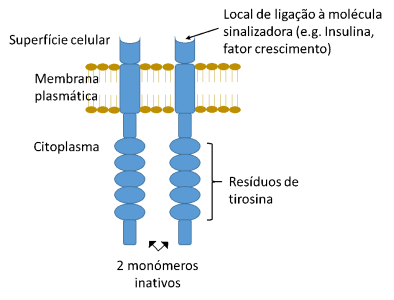
Figura 1 – Esquema genérico de um receptor tirosina quinasa en estado inactivo, es decir, no unido a la molécula señalizadora extracelular.
Proteínas no receptoras de tirosina quinasa
Las proteínas no receptoras de tirosina quinasa (NRTK) son componentes clave de las cascadas de señalización desencadendas por los receptores celulares, inclusive los receptores de tirosina quinasa. Su función es fosforilar proteínas, es decir, transfieren un grupo fosfato a partir de la molécula de ATP para una proteína objetivo. El fosfato es unido específicamente al grupo hidroxílico en la cadena lateral de los residuos de tirosina.
La mayoría de estas proteínas están localizadas en el citoplasma y no presenta elementos que caracterizan los receptores, tales como un dominio de unión a una molécula señalizadora extracelular y un dominio que atraviese la membrana plasmática.
Algunas NRTK se encuentran ancladas a la membrana celular a través de una modificación aminoterminal.
Las NRTK, además del dominio tirosina quinasa que las caracteriza, poseen dominios que median las interacciones proteína-proteína, proteína-lípido y proteína-ADN.
Los dominios de interacción proteína-proteína más comúnmente encontrados en NRTKs son los dominios de homología Src 2 (SH2) y Src 3 (SH3).
El dominio SH2 es un dominio compacto de aproximadamente 100 residuos que se une a residuos de fosfotirosina.
El dominio SH3 de menores dimensiones (cerca de 60 residuos) se une a secuencias conteniendo prolina y capaces de formar una hélice de tipo II de poliprolina.
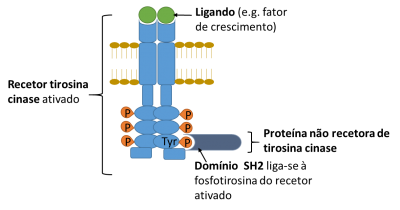
Figura 2 – Esquema ilustrando la unión de una proteína no receptora de tirosina quinasa (NRTK) conteniendo el domínio SH2 al receptor de tirosina quinasa (RTK) activado por interacción con la fosfotirosina (P-tyr).
Ejemplos de este tipo de proteínas más comunes son las Src, las Janus quinasas (Jaks) y Abl.
Las proteínas Src, divididas en 9 subtipos, fueron inicialmente identificadas como la proteína oncogénica del virus sarcoma Rous y fueron la primera proteína que se demostró poseer actividad de tirosina quinasa.
Las Jaks se dividen en 4 subtipos relacionados y están asociados a la señalización por receptores de citocina.
La proteína Abl contiene una señal de localización nuclear y es encontrado tanto en el núcleo como en el citoplasma. Además de los dominios SH2 y SH3, la Abl posee un dominio de unión a la actina F y un dominio de unión al ADN.
References:
- Cooper, G. M., & Hausman, R. E. (2013).The cell: a molecular approach (6th ed.). Washington: ASM ; Sunderland.
- Hubbard, S.R. & Till, J.H. (2000).Protein Tyrosine Kinase Structure and Function. Rev. Biochem., 69: 373–398.
- Hubbard, R. & Miller, W.T. (2007). Receptor tyrosine kinases: mechanisms of activation and signaling. Curr Opin Cell Biol., 19(2): 117–123.
- Lemmon M.A. & Schlessinger J. (2010). Cell signaling by receptor-tyrosine kinases. Cell, 141(7): 1117–1134.




