O termo “química verde”, ou “química sustentável”, refere-se ao desenho racional de processos químicos cada vez mais limpos, eficientes e sustentáveis. Não se trata de um ramo individual mas sim de um conceito, ou filosofia, que se aplica a diversas áreas da química.
Os três grandes pilares da química verde são a utilização, tanto quanto possível, de matérias primas de origem renovável, a eficiência energética e a não utilização ou produção de substâncias nocivas ao meio ambiente.
A Agência de Protecção Ambiental Americana propõe 12 princípios da química verde, listados a seguir:
- É melhor não produzir resíduos do que ter que os limpar depois;
- As rotas de síntese devem ser desenhadas de modo a que o máximo de átomos presentes nos reagentes sejam incorporados no produto final;
- Tanto quanto possível, as reacções de síntese devem utilizar e produzir substâncias pouco ou nada tóxicas para o ser humano e o meio ambiente;
- Os produtos químicos devem ser desenhados de modo a preservar a eficácia na sua função ao mesmo tempo que se reduz a toxicidade;
- O uso de substâncias auxiliaries, como solventes, é idealmente tornado desnecessário. Tal não sendo possível, essas mesmas substâncias devem ser inócuas;
- O gasto de energia deve ser minimizado. Idealmente, as reacções decorrem à temperatura e pressão ambiente;
- Sempre que possível, técnica e economicamente, as matérias-primas devem ser de fonte renovável;
- Evitar recorrer à derivatização (bloquear um grupo, protecção/desprotecção, modificação temporária) já que esta requer a utilização de reagentes adicionais e, tipicamente, produz resíduos;
- Reagentes catalíticos, sempre que disponíveis, são preferíveis aos reagentes estoquiométricos;
- Os produtos químicos devem ser desenhados de modo a que, após terem cumprido a sua função, se degradem em produtos inócuos e não persistentes;
- Futuras metodologias analíticas devem incorporar a análise em tempo real da formação de substâncias poluentes, de modo a que esta possa ser evitada;
- As substâncias utilizadas num processo químico devem ser escolhidas de modo a minimizar o risco de acidente como explosões, derrames e incêndios.
De modo a poder facilmente avaliar o quão “verde” é um processo químico foram já propostas na literatura diversas métricas. As mais conhecidas, “economia atómica” e “e-factor” foram introduzidas nos anos 90 e operaram uma revolução no design químico.
O termo “economia atómica” refere-se à eficiência da utilização de átomos numa reacção, assumindo um rendimento de 100%. Quer isto dizer que a “economia atómica” é um conceito teórico e pretende avaliar o quão eficiente uma reacção é com base apenas na sua estequiometria, ou seja, prevê qual é o mínimo possível de resíduo que uma reacção irá gerar. A fórmula de cálculo da “economia atómica” é a seguinte:
Economia atómica = M(Produto desejado) / M(Reagentes)
onde M é a massa molecular. Numa situação ideal a economia atómica é de 100%, ou seja, não se formam quaisquer sub-produtos, apenas o produto desejado.
Já o “e-factor” reflecte o quão “verde” um processo é na realidade, medindo quantos kg de resíduo são produzidos para fabricar 1 kg do produto desejado, ou seja,
E – factor = kg(resíduos) / kg(produto desejado)
Aqui, cada autor ou empresa define “Resíduos” como entender podendo ou não, além dos óbvios sub-produtos de reacção, incluir a massa de solventes utilizados, a energia térmica usada em operações de aquecimento e arrefecimento, a massa de catalisador ou outros aditivos que não possam ser recuperados, etc. O e-factor ideal é zero.
Na maioria dos casos, as reacções têm rendimentos abaixo dos 100%. Assim, mesmo que encontremos a reacção ideal, com 100% de economia atómica e sem recorrer a solventes, basta uma parte dos reagentes não reagir, ou serem gerados produtos secundários não previstos na reacção original, para o E-factor ser superior a zero, uma situação que na prática já não é a ideal.
Infelizmente, a indústria química ainda está muito longe de se aproximar sequer de um “e-factor” igual a zero. A Tabela 1 mostra os e-factors tipicamente encontrados em diferentes ramos da indústria. As refinarias de petróleo sobressaem como um bom exemplo, mas isto deve-se ao facto de praticamente não recorrer a reacções mas antes se limitar a separar e purificar fracções do petróleo. A indústria farmacêutica é a mais poluente, já que recorrer a rotas de síntese com vários passos intermédios, que utilizam diferentes reagentes e solventes. A soma de resíduos gerados por cada kg de medicamento produzido está na ordem dos 25 a 100 kg, isto é, produz 25 a 100 vezes mais resíduo que produto!
Tabela 1 E-factors na indústria química. Tabela adaptada de Lenardão, 2003.
| Sector da indústria | Volume de produção anual (toneladas) | E-factor (kg de resíduo por kg de produto) |
| Refinarias de petróleo | 106 – 108 | < 0,1 |
| Química pesada | 104 – 106 | < 1 – 5 |
| Química Fina | 102 – 104 | 5 – 50 |
| Farmacêutica | 10 – 103 | 25 – 100 |
A boa notícia é que o conceito de “química verde”, sendo apelativo não só do ponto de vista ambiental como também do económico, tem crescido rapidamente nas duas últimas décadas, havendo um enorme interesse da indústria em tornar as suas tecnologias mais limpas.
A American Chemical Society atribui, desde 1995, os “Presidential Green Chemistry Challenge Awards”, uma espécie de óscares da química verde, com o objectivo de salientar exemplos de boas práticas nesta área. A lista completa de premiados pode ser consultada em http://www2.epa.gov/green-chemistry/presidential-green-chemistry-challenge-winners .
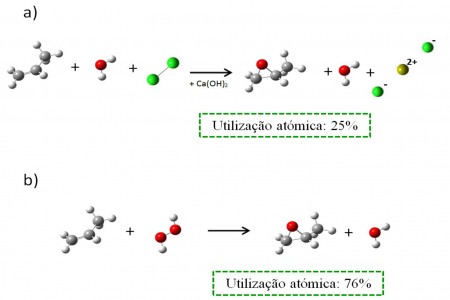
O seguinte exemplo retirado da literatura irá ilustrar os conceitos até então apresentados e permitir-lhe-á testar o quanto aprendeu. As reacções a) e b), representadas na Fig. 1, são duas rotas de síntese distintas para o fim comum de oxidar o metiletileno dando origem ao óxido de propileno. Qual das duas é um melhor exemplo de química “verde”? Porquê?
Fig. 1 Duas rotas de síntese, a) e b), para a produção de óxido de etileno a partir de metiletileno (ref: Sheldon,2008). Na figura cada cor representa um elemento, seguindo esta chave: branco – hidrogénio; cinzento – carbono; vermelho – oxigénio; verde – cloro; amarelo – cálcio.
Na rota a), a clássica via da clorohidrina, apenas 25% da massa de todos os átomos que constituem os reagentes é incorporada no produto final, o óxido de propileno. Já a rota b) utiliza peróxido de hidrogénio para oxidar o metiletileno, sendo uma molécula de água o único sub-produto gerado. Neste caso, a economia atómica é muito superior, já que 76% da massa atómica inicial está presente no produto final. Além disto, na reacção a) é produzido um sal de cloreto de cálcio, que terá depois que ser separado do óxido de etileno, requerendo gasto adicional de solvente, energia e tempo ao passo que na reacção b) é apenas necessário evaporar a água presente na mistura reaccional. Por último, a reacção b) utiliza peróxido de hidrogénio, um reagente menos nocivo que a clorohidrina e não produz resíduos tóxicos. É pelas três razões assim enumeradas que a reacção b) é mais “verde” que a reacção a).
Saber mais:
Lenardão, E.J. et. al., 2003, “Green chemistry” – Os 12 princípios da química verde e sua inserção nas atividades de ensino e pesquisa. Química Nova, vol. 26 nº 1, p. 123-129.
Sheldon, R.A., 2008, E factors, green chemistry and catalysis: an odyssey. Chemical Communications, p. 3352–3365.
Constable, D.J.C., Curzons, A.D. e Cunningham, V.L, 2002, Metrics to ‘green’ chemistry—which are the best?, Green Chemistry, 4, p. 521–527.