O agente infeccioso
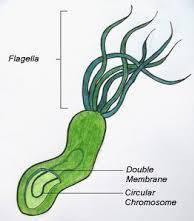
Helicobacter pylori é um bacilo Gram-negativo, que possui uma forma helicoidal e pertence à família Enterobacteriaceae.
Esta pequena bactéria geralmente possui um cumprimento entre 2 a 4 μm e um diâmetro que varia entre 0,5 e 1 μm.
Possui um cromossoma circular e é envolvida por uma dupla membrana – uma membrana interna (citoplasmática); periplasma e uma membrana externa de fosfolipídios e LPS (lipopolissacarídeos).
Este organismo é considerado um patógeno extracelular capaz de colonizar a superfície da mucosa gástrica dos seres humanos. H. pylori normalmente apresenta entre 2 a 6 flagelos unipolares com cerca de 3 μm de comprimento cada, os quais são importantes para a rápida mobilidade da bactéria na mucosa gástrica.
É um patógeno microaerofílico (requer baixos níveis de oxigénio) e o seu ótimo crescimento ocorre na presença de 5 a 15% de oxigénio.
Em 1994, a Agência Internacional para Pesquisa no Cancro (AIPC), uma organização subordinada da Organização Mundial de Saúde (OMS), considerou esta bactéria um carcinogénio do tipo I, devido à sua íntima associação com o cancro gástrico.
Possíveis vias de transmissão
O modo de transmissão da infeção por H. pylori continua ainda pouco compreendido. Possíveis vias de transmissão propostas incluem: de pessoa para pessoa, por iatrogenia e por contacto com água contaminada.
Transmissão de uma pessoa para outra é o modo de transmissão mais provável, principalmente de pais para filhos ou de uma criança para outra, no entanto, ainda não se sabe exatamente como esta ocorre. Especula-se que seja via oral-oral ou via fecal-oral, sendo o primeiro caso o mais provável e que inclui possível transmissão através da saliva, placa dentária e refluxo do conteúdo gástrico ou vómito.
Outra via de transmissão proposta é de um paciente infetado para outro paciente, por exemplo, por meio do uso do mesmo material médico de diagnóstico, como o endoscópio, que se encontraria contaminado. No entanto, é de referir que apesar da transmissão nasocomial ser o único modo de transmissão comprovado, em termos quantitativos este é considerado insignificante.
Outra via de transmissão provável é através da água, devido a uma possível contaminação fecal.
Apesar de o único reservatório importante da H. pylori ser a mucosa gástrica humana, esta bactéria também já foi isolada a partir de primatas não – humanos e de gatos domésticos; contudo esta infeção é incomum e como tal não necessita ser considerado um problema de saúde público.
Epidemiologia
A infeção por H. pylori possui uma elevada prevalência, sendo que cerca de 50% da população mundial encontra-se infetada. É considerado um problema de saúde tanto nos países em desenvolvimento como nos países desenvolvidos, possuindo uma prevalência de cerca de 70% e entre 30 e 40%, respetivamente.
A prevalência da infeção depende nomeadamente da área geográfica, raça, etnia, idade e condição sócio-económica. A bactéria H. pylori é geralmente adquirida na infância, sendo considerada a idade até aos 10 anos um fator de risco adicional. Para além disso, a infeção pode permanecer por décadas a não ser que seja tratada com esquemas terapêuticos que envolvem uma combinação de fármacos, incluindo antibióticos.
Contudo, a maioria das pessoas infetadas por H. pylori não desenvolve sintomas desta colonização. Apenas 15 a 20% dos indivíduos infetados desenvolvem problemas clínicos mais severos, como úlceras gastroduodenais, linfoma MALT ou cancro gástrico. Pensa-se que o risco da infeção evoluir para doenças mais severas deve-se a uma combinação de fatores, como diferenças na suscetibilidade genética do hospedeiro a estirpes específicas da H. pylori, diferenças genéticas entre as estirpes da H. pylori e a fatores ambientais, como tabagismo, consumo de álcool, dieta e alto consumo de sal. Alguns estudos sugerem que dietas ricas em antioxidantes, frutas, vegetais e vitamina C possuem um efeito protetor contra o risco de infeção e desenvolvimento das doenças.
Doenças
Helicobacter pylori é etiologicamente associada a várias doenças gastroduodenais.
A infeção por H. pylori conduz sempre a uma inflamação da mucosa gástrica, sendo, inclusive, esta bactéria, o principal agente etiológico da gastrite superficial crónica (infiltrado celular de células imunes (mononucleares e polimorfonucleares) na mucosa gástrica).
Em cerca de 5% dos pacientes infectados com a bactéria, a gastrite pode evoluir para atrofia gástrica.
A infeção por H. pylori tem sido associada ao desenvolvimento da úlcera péptica (tanto duodenal como gástrica), sendo que pacientes infetados possuem um risco entre 10 a 20% de desenvolver ulceração. A infeção por este bacilo também tem sido associada a um aumento do risco de desenvolver adenocarcinoma gástrico, sendo que este ocorre entre 1 a 2% dos indivíduos infetados. Por último, a infeção por H. pylori também pode conduzir a um linfoma MALT (mucosa-associated lymphoid tissue), o qual ocorre em menos de 1% dos pacientes infetados.
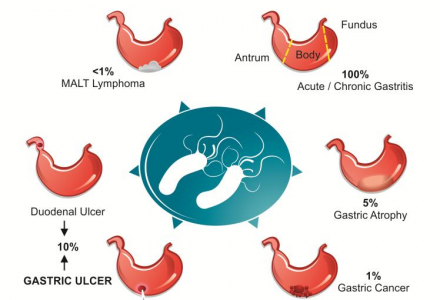
Representação esquemática das doenças relacionadas com a infeção por H. pylori. De Negrei, C., & Boda, D. (2014). The Mechanisms of Action and Resistance to Fluoroquinolone in Helicobacter pylori Infection.
Colonização e Fatores de virulência
A H. pylori possui a capacidade de colonizar a superfície do antro e do corpo do estômago, possuindo um tropismo para as junções intercelulares das células epiteliais gástricas.
H. pylori foi isolada pela primeira vez em 1982 por Warren e Marshall, contudo esta bactéria coloniza os seres humanos há pelo menos 58.000 anos e encontra-se muito bem adaptada para conseguir sobreviver na mucosa gástrica humana. Para além disso, erradicação espontânea desta bactéria do estômago humano é um evento raro.
Resumidamente, o mecanismo de colonização pela H. pylori envolve quatro principais etapas:
- penetração nas criptas das células epiteliais da superfície do estômago;
- adaptação ao ambiente;
- fixação às células epiteliais;
- inflamação da mucosa gástrica / aumento das espécies reativas de oxigénio (ERO) e nitrogénio (ERN), resultado numa gastrite crónica.
Após a exploração dos mecanismos de defesa do hospedeiro, o patógeno pode adquirir nutrientes e consequentemente replicar-se com sucesso.
A colonização da mucosa gástrica requer um complexo processo adaptativo. Neste contexto, as principais características que permitem a H. pylori desenvolver-se no estômago são:
- Mobilidade e penetração na camada de muco viscoso do estômago devido à presença de flagelos e da forma helicoidal, respetivamente;
- Capacidade para alterar o pH do estômago através da produção da enzima urease, a qual hidrolisa a ureia em amónia e dióxido de carbono, aumentando deste modo o pH no estômago e consequentemente protegendo a bactéria da acidez gástrica;
- Presença de adesinas bacterianas que permitem que a bactéria se ligue à superfície das células epiteliais, como as adesinas HpaA (H. pylori adhesion A); BabA (blood group antigen-binding adhesin); SabA (sialic acid binding adhesin) e OMPs (outer membrane proteins);
- Indução de uma resposta inflamatória, devido à presença de LPS na membrana externa, por exemplo;
- Produção de fatores de virulência, como por exemplo, as citotoxinas VacA (vacuolating cytotoxin A); CagA (cytotoxin associated gene A); CagPAI (CagA pathogenicity Island), CagE (cytotoxin associated gene B), IceA (induced by contact with epithelium) e HP-NAP (neutrophils-activating protein). A proteína CagA afeta a transdução de sinais nas células do hospedeiro e é associada com uma proeminente resposta inflamatória, com o rearranjo do citoesqueleto e com a presença de cagPAI (grupo de genes que codificam um sistema de secreção bacteriano). Já a citotoxina VacA é associada à formação de vacúolos em culturas celulares, disrupção de junções epiteliais, fragmentação das mitocôndrias e indução da apoptose na mucosa gástrica.
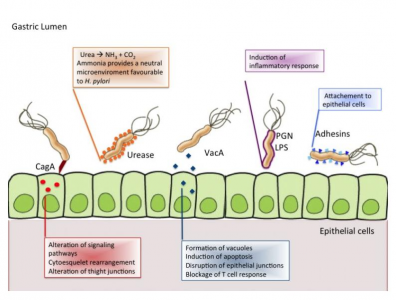
Fatores de virulência da Helicobacter pylori. Morales-guerrero, S. E., Mucito-varela, E., Aguilar-gutiérrez, G. R., Lopez-vidal, Y., & Castillo-rojas, G. (2001). The Role of CagA Protein Signaling in Gastric Carcinogenesis — CagA Signaling in Gastric Carcinogenesis.
Diagnóstico
Atualmente existem diversos métodos de diagnóstico comummente empregues para detetar a presença da bactéria H. pylori na mucosa gástrica. Estes podem ser considerados não invasivos ou invasivos quando baseados na biopsia endoscópica. No primeiro grupo incluem-se o teste de depuração respiratória com C13 (carbonon-13); a pesquisa de antígenos da H. pylori nas fezes e a sorologia que tem por base a presença de anticorpos IgG anti-H. pylori. Nos testes invasivos inclui-se o exame histológico, cultura e teste da urease na biopsia.
References:
- Dunn, B. E., & Cohen, H. (2000). Helicobacter pylori, 10(4), 720–741.
- Kusters, J. G., van Vliet, A. H. M., & Kuipers, E. J. (2006). Pathogenesis of Helicobacter pylori infection. Clinical Microbiology Reviews, 19(3), 449–90.
- Marais, A., Mendz, G. L., Hazell, S. L., & Me, F. (1999). Metabolism and Genetics of Helicobacter pylori : the Genome Era, 63(3), 642–674.
- Polk, D. B., & Peek, R. M. (2010). Helicobacter pylori: gastric cancer and beyond. Nature Reviews. Cancer, 10(6), 403–14.
- Sepulveda, A. R. (2013). Helicobacter, Inflammation, and Gastric Cancer. Current Pathobiology Reports, 1(1), 9–18.
- Brown, L. M. (2000). Helicobacter pylori: Epidemiology and Routes of Transmission. Epidemiologic Reviews, 22(2), 283–297.
- Vincent, P. (1995). Transmission and acquisition of Helicobacter pylori infection: evidences and hypothesis.
- Gaddy, J. A., Radin, J. N., Loh, J. T., Zhang, F., Washington, M. K., Peek, R. M., … Cover, T. L. (2013). High dietary salt intake exacerbates Helicobacter pylori-induced gastric carcinogenesis. Infection and Immunity, 81(6), 2258–67.
- Yamaoka, Y. (2010). Mechanisms of disease: Helicobacter pylori virulence factors. Nature Reviews. Gastroenterology & Hepatology, 7, 629–41.
- O′Toole, P. W., Lane, M. C., & Porwollik, S. (2000). Helicobacter pylori motility. Microbes and Infection, 2(10), 1207–1214.
- Machado, A. M. D., Figueiredo, C., Seruca, R., & Rasmussen, L. J. (2010). Helicobacter pylori infection generates genetic instability in gastric cells. Biochimica et Biophysica Acta, 1806(1), 58–65.
- Basso, D., Zambon, C.-F., Letley, D. P., Stranges, A., Marchet, A., Rhead, J. L., … Atherton, J. C. (2008). Clinical relevance of Helicobacter pylori cagA and vacA gene polymorphisms. Gastroenterology, 135(1), 91–9.
- Cover, T. L. (1996). MicroReview: The vacuolating cytotoxin of Helicobacter pylori. MolecularMicrobiology, 20, 241–246.
- Jain, P., Luo, Z., & Blanke, S. R. (2011). Helicobacter pylori vacuolating cytotoxin A (VacA) engages the mitochondrial fi ssion machinery to induce host cell death.
- Palframan, S. L., Kwok, T., & Gabriel, K. (2012). Vacuolating cytotoxin A (VacA), a key toxin for Helicobacter pylori pathogenesis. Frontiers in Cellular and Infection Microbiology.
- Graham, D. Y., & Yamaoka, Y. (1998). H. pylori and cagA: Relationships with Gastric Cancer, Duodenal Ulcer, and Reflux Esophagitis and Its Complications. Helicobacter, 3(3), 145–151.