Conceito de Entropia
Em termodinâmica o termo Entropia designa uma grandeza fundamental que fornece uma medida da quantidade de desordem num sistema físico. De acordo com a segunda lei da termodinâmica, a quantidade total de entropia em qualquer sistema físico isolado ou aumenta ou mantém-se constante. Se definirmos S como a entropia, tal significa que DS>0.
O conceito de entropia foi inicialmente desenvolvido pelo engenheiro e pesquisador francês Nicolas Sadi Carnot. Durante as suas pesquisas sobre transformação da energia mecânica em energia térmica e vice-versa, Carnot constatou que seria impossível que existisse uma máquina térmica com eficiência total, o que significa que o trabalho pode ser convertido em calor (energia térmica), mas a energia térmica não pode ser completamente convertida em trabalho, o seja, o processo não é reversível. Mais tarde, Lord Kelvin complementou as pesquisas de Carnot sobre a irreversibilidade dos processos termodinâmicos, dando origem às bases da Segunda Lei da Termodinâmica. Em 1865, Rudolf Clausius define a Entropia como a parcela de energia térmica que não pode mais ser convertida em energia mecânica em transformações termodinâmicas a uma dada temperatura.
Algebricamente,
DS = Q/T, em que DS é a variação da entropia, Q o calor transferido e T a temperatura.
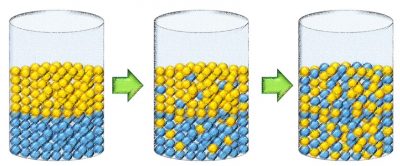
Muitas vezes, o conceito de entropia é ilustrado com o conceito de desordem. Na imagem abaixo foram colocadas bolas amarelas e bolas azuis num pote. No início as bolas estão ordenadas por cores mas à medida que se agita o pote, a desordem vai aumentando. E cada vez mais, nunca sendo possível reverter o processo.