Notion de Spectre d’absorption
Le Spectre d’absorption d’un composé donné est défini comme étant le spectre du rayonnement électromagnétique ou lumineux qui présente des portions de radiations qui ont été absorbées et qui apparaissent sous forme de raies ou de bandes noires.
Lumière visible
La lumière est composée de particules énergétiques, appelés photons, qui ont une quantité spécifique d’énergie, correspondant à une fréquence ou longueur d’onde spécifique, mesurée en nanomètres (nm).
La lumière visible à l’œil humain comprend la gamme de longueurs d’onde entre 380 nm et 720 nm et n’est qu’une petite partie du spectre électromagnétique, comprenant également une vaste gamme de rayonnement que nos yeux ne peuvent pas détecter (Ultraviolets, Infrarouges, Rayons X, etc.) (Fig. 1).

Figure 1. Le spectre de lumière visible
Absorption et spectre d’absorption
Lorsque toutes les longueurs d’onde de la lumière visible sont présentes, la lumière apparaît blanche. La couleur affichée pour un composé ou objet donné est déterminée par les longueurs d’onde de la lumière blanche que celui-ci absorbe.
En simplifiant, un composé qui apparaît bleu transmet ou reflète la lumière bleue et absorbe les couleurs restantes du spectre de la lumière visible. D’un autre côté, la couleur présentée peut également être due à une forte absorption de la lumière dans la gamme de sa couleur « complémentaire ». Par conséquent, une forte absorption de photons « rouges », fait que le composé appariasse vert à nos yeux. Le cercle chromatique (Fig. 2) permet de visualiser la complémentarité entre les longueurs d’onde absorbées et les longueurs d’onde transmises ou réfléchies.
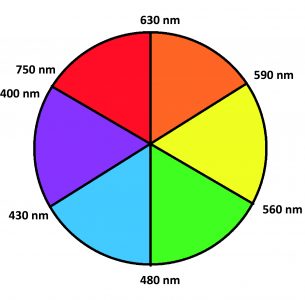
Figure 2. Cercle chromatique simplifié
Le spectre d’absorption est facilement observable grâce à l’expérience suivante.

Lorsque la lumière blanche frappe une substance (liquide ou gaz), elle va la traverser. Puis, elle passe par une fente et le faisceau résultant passe, à son tour, à travers un prisme qui va la décomposer. On observe alors le spectre d’absorption de la substance en question. Les raies ou bandes noires observées se trouvent dans les gammes de longueurs d’ondes qui ont été absorbées.
L’emplacement des raies, correspondant à des longueurs d’onde spécifiques, est caractéristique d’un élément chimique. Le spectre d’absorption nous indique ainsi la portion de la radiation électromagnétique incidente (dans ce cas, de la lumière visible) qui a été absorbée, ce qui permet d’identifier la composition d’une substance.
Le spectre d’absorption est déterminé par la quantité de lumière absorbée en fonction de la longueur d’onde par des techniques de spectroscopie.
En laboratoire de biologie ou physique-chimie, il est possible, avec l’aide d’un spectrophotomètre, de mesurer l’absorbance (absorption de certaines longueurs d’onde) d’un échantillon donné et donc d’obtenir des indications sur sa composition en analysant les spectres d’absorption (Fig. 3.).
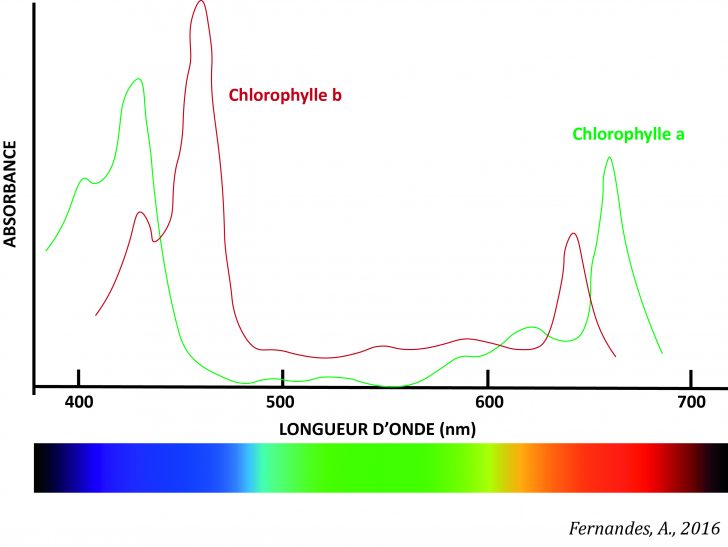
Fig. 3. Spectre d’absorption de la chlorophylle a et b
Ainsi, nous savons que le spectre d’absorption de la chlorophylle a deux pics. Plus précisément, a 665 nm et 465 nm pour la chlorophylle a et 640 nm et 450 nm pour la chlorophylle b. La chlorophylle absorbe dans les bandes rouges et bleues et réfléchit la lumière verte.
References:
- Jørgensen, C. (1962). Absorption spectra and chemical bonding in complexes. 1st ed. Oxford : Pergamon Press.
- Karp, G. and Pruitt, N. (2008). Cell and molecular biology. 1st ed. Hoboken, N.J.: John Wiley & Sons.
- Tkachenko, N. (2006). Optical spectroscopy. 1st ed. Amsterdam : Elsevier.




